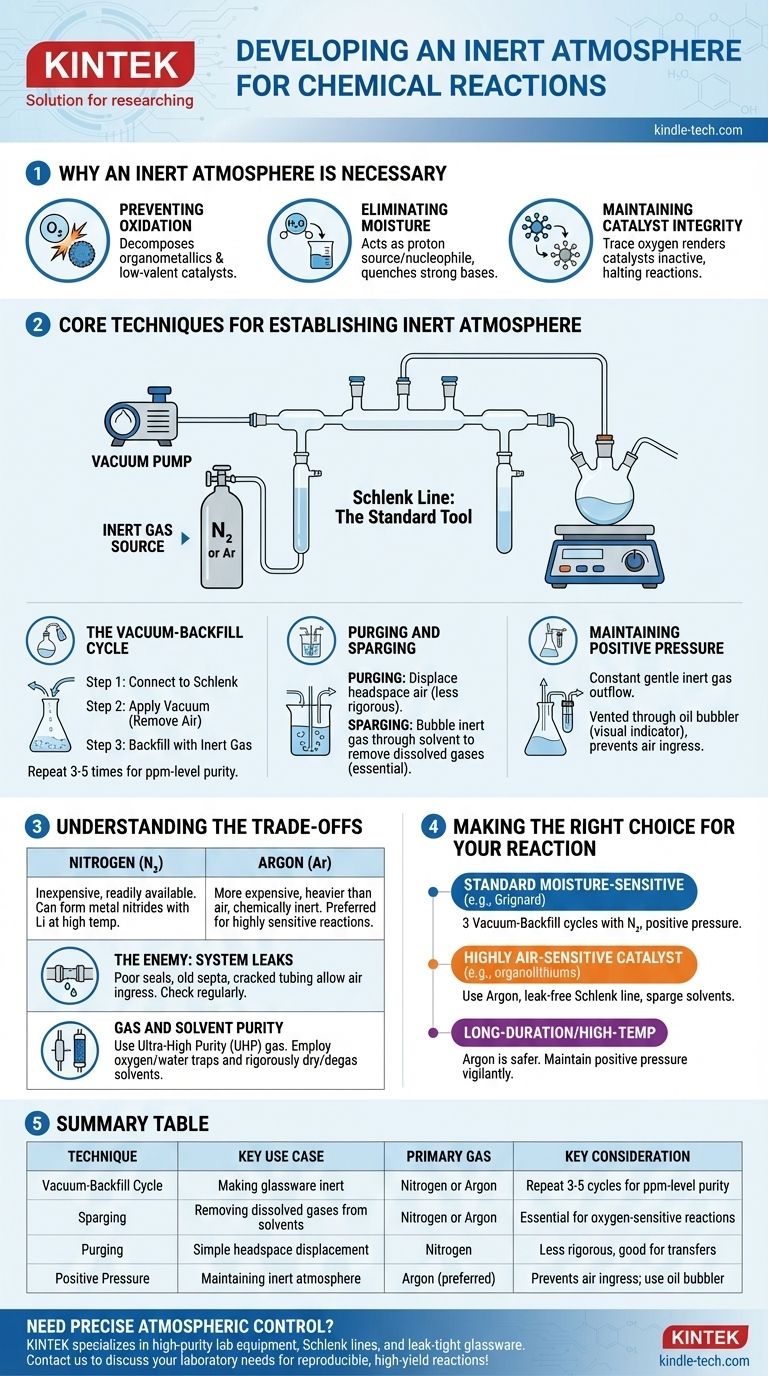
Na prática, uma atmosfera inerte é criada pela remoção física do ar reativo de um recipiente de reação e sua substituição por um gás não reativo, mais comumente nitrogênio ou argônio. Isso é tipicamente alcançado usando um sistema de manifold duplo chamado linha Schlenk, que permite ao químico alternar entre aplicar vácuo ao recipiente e reabastecê-lo com o gás inerte. Este ciclo é repetido várias vezes para garantir que todo o oxigênio e umidade sejam removidos.
O objetivo central não é simplesmente adicionar um gás inerte, mas sim deslocar e remover rigorosamente a atmosfera reativa já presente. Dominar este controle sobre o ambiente de reação é fundamental para prevenir reações colaterais indesejadas e garantir a integridade de materiais sensíveis.

Por Que Uma Atmosfera Inerte é Necessária
Muitas reações químicas envolvem reagentes ou produzem produtos que são sensíveis aos componentes do ar ambiente. A falha em controlar a atmosfera pode levar a reações fracassadas, baixos rendimentos ou à formação de subprodutos perigosos.
Prevenção da Oxidação
O culpado mais comum é o **oxigênio molecular (O₂) **, um poderoso agente oxidante. Ele pode reagir e decompor facilmente muitos reagentes comuns, especialmente organometálicos, catalisadores metálicos de baixa valência e intermediários radicais.
Eliminação da Umidade
O **vapor de água (H₂O)** é outra grande preocupação. Ele atua como uma fonte de prótons (um ácido fraco) e um nucleófilo, o que pode "apagar" bases fortes (como reagentes de Grignard ou organolítios) ou reagir com compostos altamente eletrofílicos (como cloretos de ácido).
Manutenção da Integridade do Catalisador
Em catálise, o estado ativo de um catalisador metálico está frequentemente em um estado de oxidação específico e baixo. A exposição a quantidades vestigiais de oxigênio pode oxidar irreversivelmente o catalisador, tornando-o inativo e interrompendo a reação.
Técnicas Essenciais para Estabelecer uma Atmosfera Inerte
A ferramenta padrão para este processo é uma linha Schlenk, um manifold de vidro conectado tanto a uma bomba de vácuo quanto a uma fonte de gás inerte de alta pureza. Esta configuração permite duas técnicas principais.
O Ciclo de Vácuo-Reabastecimento
Este é o método mais comum para tornar o material de vidro inerte.
- O balão de reação vazio e seco é conectado à linha Schlenk.
- Aplica-se um vácuo, removendo a maior parte do ar do balão.
- O vácuo é fechado, e a válvula de gás inerte é aberta, reabastecendo o balão com nitrogênio ou argônio até a pressão ambiente.
Este ciclo é tipicamente repetido de três a cinco vezes para reduzir a concentração de oxigênio e umidade a níveis insignificantes (partes por milhão).
Purga (Purging) e Borbulhamento (Sparging)
Purga envolve simplesmente passar um fluxo constante de gás inerte através do espaço livre do balão para deslocar o ar. Este é um método menos rigoroso, mas pode ser útil para transferências simples.
Borbulhamento (Sparging) é o processo de borbulhar o gás inerte através de um líquido (como um solvente de reação) através de uma agulha ou tubo longo. Isso é essencial para remover gases dissolvidos, especialmente oxigênio, do solvente antes que a reação comece.
Manutenção da Pressão Positiva
Uma vez estabelecida a atmosfera inerte, uma leve pressão positiva do gás inerte é mantida durante todo o experimento. Isso garante um fluxo constante e suave de gás, impedindo que qualquer ar vaze para dentro do sistema. Este fluxo de saída é tipicamente ventilado através de um borbulhador de óleo ou mercúrio, que também serve como um indicador visual da taxa de fluxo de gás.
Compreendendo as Compensações
Escolher o gás certo e estar ciente das limitações do sistema são cruciais para o sucesso. Embora essas técnicas sejam poderosas, elas não são infalíveis.
Nitrogênio vs. Argônio
Nitrogênio (N₂) é o "cavalinho de batalha" para a maior parte da química de atmosfera inerte. É barato e prontamente disponível. No entanto, sob certas condições (por exemplo, reações com lítio metálico em altas temperaturas), pode ser reativo, formando nitretos metálicos.
Argônio (Ar) é significativamente mais caro, mas é mais pesado que o ar e quimicamente inerte em praticamente todas as condições de laboratório. É o gás de escolha para reações altamente sensíveis ou aquelas que envolvem metais que podem reagir com N₂.
O Inimigo: Vazamentos no Sistema
A eficácia da sua atmosfera inerte é tão boa quanto a vedação mais fraca em sua configuração. Juntas de vidro mal lubrificadas, septos de borracha antigos ou tubos rachados podem permitir que o ar vaze lentamente de volta para o sistema, comprometendo a reação. Verificar regularmente se há vazamentos com um manômetro de vácuo é uma prática padrão.
Pureza do Gás e do Solvente
Simplesmente usar um cilindro de gás inerte não é suficiente. Para trabalhos extremamente sensíveis, é necessário gás de pureza ultra-alta (UHP). Além disso, armadilhas de oxigênio ou água podem ser colocadas em linha para "remover" os últimos vestígios de contaminantes do gás antes que ele entre no manifold. Da mesma forma, os solventes devem ser rigorosamente secos e desgasificados (muitas vezes por borbulhamento) antes do uso.
Fazendo a Escolha Certa Para Sua Reação
Sua abordagem específica deve ser adaptada à sensibilidade de seus reagentes e ao objetivo de seu experimento.
- Se o seu foco principal é uma reação padrão sensível à umidade (por exemplo, Grignard): Realizar três ciclos de vácuo-reabastecimento com nitrogênio e manter a pressão positiva é tipicamente suficiente.
- Se o seu foco principal é uma reação usando um catalisador ou reagente altamente sensível ao ar (por exemplo, organolítios, níquel de baixa valência): Usar argônio, garantir uma linha Schlenk sem vazamentos e borbulhar seus solventes são cruciais para o sucesso.
- Se o seu foco principal é uma reação de longa duração ou alta temperatura: O argônio é a escolha mais segura para evitar possíveis reações colaterais com o nitrogênio, e você deve permanecer vigilante quanto à manutenção da pressão positiva durante todo o tempo da reação.
Dominar essas técnicas de controle atmosférico é o que lhe confere verdadeiro comando sobre o ambiente químico, transformando uma reação de uma questão de sorte em um processo previsível e reprodutível.
Tabela de Resumo:
| Técnica | Caso de Uso Principal | Gás Principal | Consideração Chave |
|---|---|---|---|
| Ciclo Vácuo-Reabastecimento | Tornar o material de vidro inerte | Nitrogênio ou Argônio | Repetir 3-5 ciclos para pureza de nível ppm |
| Borbulhamento (Sparging) | Remover gases dissolvidos de solventes | Nitrogênio ou Argônio | Essencial para reações sensíveis ao oxigênio |
| Purga (Purging) | Deslocamento simples do espaço livre | Nitrogênio | Menos rigoroso, bom para transferências |
| Pressão Positiva | Manter a atmosfera inerte | Argônio (preferido) | Impede a entrada de ar; usar borbulhador de óleo |
Precisa de controle atmosférico preciso para suas reações sensíveis? A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta pureza, incluindo linhas Schlenk, sistemas de purificação de gás e material de vidro hermético. Nossos especialistas podem ajudá-lo a selecionar a configuração correta para prevenir oxidação, eliminar umidade e manter a integridade do catalisador. Entre em contato conosco hoje para discutir suas necessidades específicas de laboratório e alcançar reações reprodutíveis e de alto rendimento!
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é um exemplo de atmosfera inerte? Descubra o Melhor Gás para o Seu Processo
- Qual é o propósito da atmosfera inerte? Um Guia para Proteger Seus Materiais e Processos
- O nitrogênio pode ser usado para brasagem? Condições Chave e Aplicações Explicadas
- Por que o nitrogênio é usado em fornos? Um escudo econômico para processos de alta temperatura
- O que é uma condição inerte? Um Guia para Prevenir Incêndios e Explosões



















