O calor necessário para a calcinação não é um valor único e universal. É uma quantidade variável que depende inteiramente do material específico que está sendo processado, da reação química subjacente e da eficiência do equipamento utilizado, como um forno ou calcinador. O cálculo desse valor requer a compreensão dos princípios químicos e das perdas do sistema no mundo real.
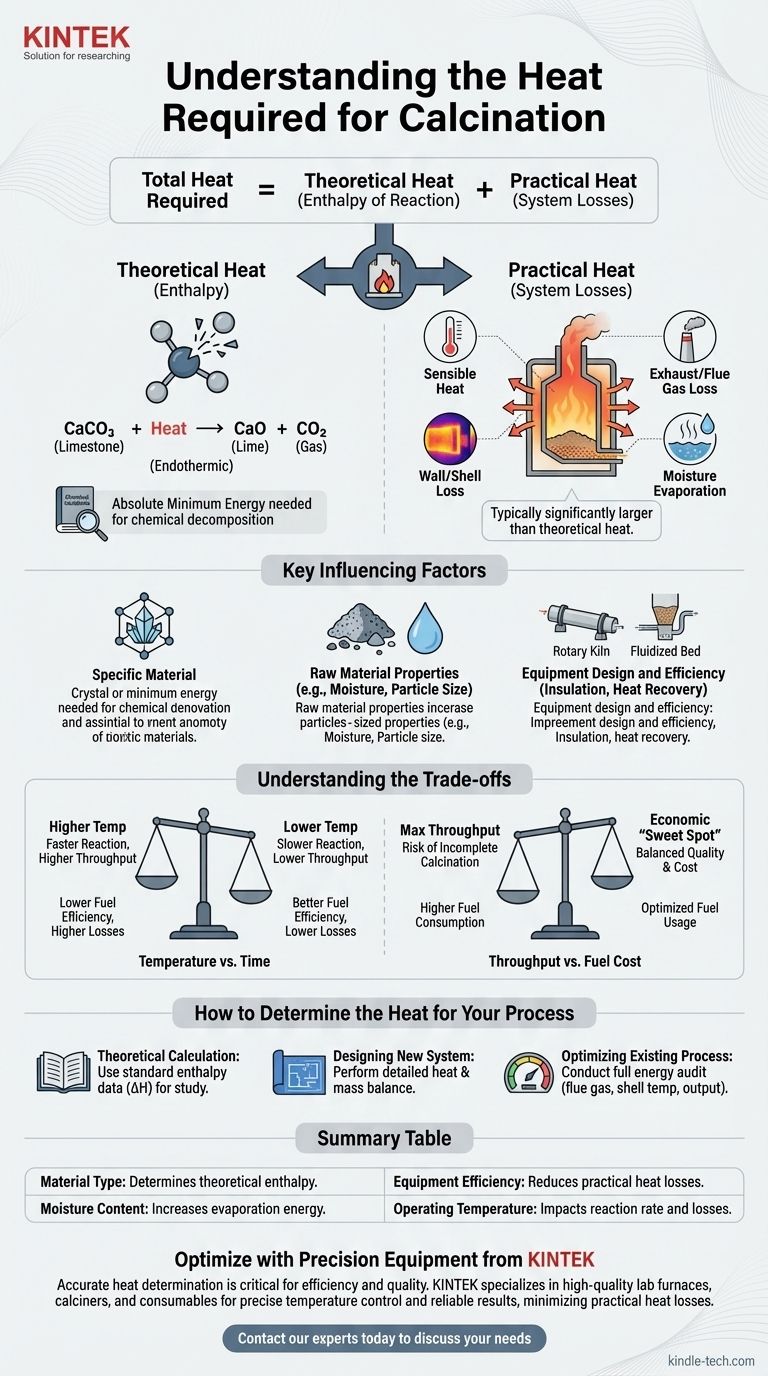
O calor total necessário para qualquer processo de calcinação é a soma de dois componentes distintos: o calor teórico da reação necessário para quebrar as ligações químicas do material e as perdas de calor práticas inerentes ao sistema operacional. Uma análise bem-sucedida deve levar em consideração ambos.

Os Dois Componentes do Calor de Calcinação
Para entender as demandas de energia da calcinação, devemos separar o mínimo teórico das realidades práticas dos equipamentos industriais.
Calor Teórico (Entalpia de Reação)
Esta é a quantidade mínima absoluta de energia exigida pelas leis da química para impulsionar a reação de decomposição.
Este valor é fixo para uma determinada transformação química. Por exemplo, a calcinação de calcário (carbonato de cálcio, CaCO₃) para produzir cal (óxido de cálcio, CaO) e dióxido de carbono (CO₂) é uma reação endotérmica, o que significa que deve absorver uma quantidade específica de energia para prosseguir.
Este requisito teórico de energia pode ser calculado ou encontrado em manuais de engenharia química para a maioria dos materiais comuns.
Calor Prático (Perdas do Sistema)
Esta é toda a energia adicional que deve ser fornecida a um sistema do mundo real além do mínimo teórico. Na maioria das operações industriais, este componente é significativamente maior do que o calor teórico da reação.
As principais fontes de perda de calor prática incluem:
- Calor Sensível: Energia usada para aquecer o próprio material até a temperatura de reação necessária.
- Perda de Gases de Exaustão/Fumaça: Calor transportado pelos gases quentes que saem do calcinador.
- Perda da Parede/Invólucro: Calor que irradia e convecta das superfícies externas do forno ou estufa.
- Evaporação de Umidade: Energia consumida para transformar qualquer água presente no material bruto em vapor antes que a reação de calcinação possa sequer começar.
Fatores Chave Que Influenciam o Requisito de Calor
O valor final de consumo de energia é o resultado de várias variáveis interativas. Entender esses fatores é crucial para o projeto e otimização do processo.
O Material Específico
Diferentes materiais têm ligações químicas e temperaturas de decomposição vastamente diferentes. A energia necessária para remover a água do gesso é muito menor do que a energia necessária para decompor o carbonato de cálcio.
Propriedades da Matéria-Prima
O estado físico do material é importante. Pós finos aquecem de forma mais uniforme do que pedras grandes, e um alto teor de umidade inicial pode aumentar drasticamente o consumo de energia devido ao alto calor de vaporização da água.
Projeto e Eficiência do Equipamento
O tipo de equipamento utilizado, como um forno rotativo, forno de eixo ou calcinador de leito fluidizado, tem um grande impacto na transferência de calor.
Fatores como a qualidade do isolamento, a eficácia das vedações de ar e a presença de sistemas de recuperação de calor (como pré-aquecedores que usam gás de exaustão quente para aquecer o material de entrada) são os principais impulsionadores da eficiência térmica geral.
Entendendo os Compromissos
A otimização de um processo de calcinação envolve o equilíbrio de objetivos operacionais concorrentes. Ignorar esses compromissos muitas vezes leva à ineficiência ou má qualidade do produto.
Temperatura vs. Tempo
Temperaturas operacionais mais altas podem acelerar a reação de calcinação, aumentando a produção. No entanto, isso geralmente leva a uma maior perda de calor através do invólucro do equipamento e dos gases de exaustão, reduzindo a eficiência do combustível.
Em contrapartida, temperaturas mais baixas conservam energia, mas exigem que o material passe mais tempo no calcinador, o que pode limitar a taxa de produção.
Produção vs. Custo do Combustível
Buscar a produção máxima pode levar à calcinação incompleta ou exigir a injeção de tanto combustível no sistema que a eficiência geral despenca.
Encontrar o "ponto ideal" econômico requer equilibrar cuidadosamente o valor do produto final com o custo do combustível consumido por tonelada.
Como Determinar o Calor para o Seu Processo
Não há uma fórmula única, mas você pode determinar o requisito de calor focando em seu objetivo específico.
- Se o seu foco principal for um cálculo teórico para estudo: Encontre a entalpia padrão de reação (ΔH) para sua decomposição química específica em uma referência de dados de termodinâmica.
- Se o seu foco principal for o projeto de um novo sistema: Você deve realizar um balanço detalhado de calor e massa que considere as propriedades do material, as especificações do equipamento e todas as perdas de calor potenciais.
- Se o seu foco principal for a otimização de um processo existente: Realize uma auditoria energética completa em seu equipamento, medindo as temperaturas dos gases de exaustão, a produção do produto e as temperaturas do invólucro para identificar e quantificar as principais fontes de perda de calor.
Em última análise, determinar com precisão o calor de calcinação vai além de um único número para uma análise abrangente do seu material e sistema específicos.
Tabela Resumo:
| Fator | Impacto no Requisito de Calor |
|---|---|
| Tipo de Material | Determina a entalpia teórica da reação (ex: calcário vs. gesso). |
| Teor de Umidade | Alta umidade aumenta significativamente a energia necessária para a evaporação. |
| Eficiência do Equipamento | Melhor isolamento e sistemas de recuperação de calor reduzem as perdas práticas de calor. |
| Temperatura de Operação | Temperaturas mais altas podem aumentar a taxa de reação, mas também as perdas de calor. |
Otimize seu processo de calcinação com equipamentos de precisão da KINTEK.
Determinar com precisão os requisitos de calor é fundamental para a eficiência e a qualidade do produto. Se você está projetando um novo sistema ou otimizando um existente, o equipamento de laboratório certo é essencial para a análise térmica precisa e testes de materiais.
A KINTEK é especializada em fornos de laboratório, calcinadores e consumíveis de alta qualidade que fornecem o controle preciso de temperatura e a confiabilidade necessários para sua pesquisa e desenvolvimento de processos. Nossas soluções ajudam você a minimizar as perdas práticas de calor e a alcançar resultados ótimos.
Entre em contato com nossos especialistas hoje mesmo para discutir suas necessidades específicas de calcinação e descobrir como a KINTEK pode aprimorar as capacidades do seu laboratório.
Guia Visual
Produtos relacionados
- Forno de Mufla de 1800℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno Muffle de 1400℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- A pirólise é cara? Desvendando a verdadeira economia da tecnologia de conversão de resíduos em energia
- Como a combustão é semelhante à pirólise? Desvendando os Caminhos da Decomposição Térmica
- Qual é a temperatura de decomposição por calcinação? Um Guia para Faixas Específicas de Materiais
- Qual é o tempo para pirólise rápida? Desbloqueie o Rendimento Máximo de Bio-óleo em Menos de 2 Segundos
- Qual é a diferença entre pirólise e combustão incompleta? O Papel Crítico do Oxigénio nos Processos Térmicos
- O processo de pirólise é ecologicamente correto? Desbloqueando o Valor de Resíduos com Tecnologia Responsável
- Qual é o uso de um forno rotativo? Obter Aquecimento Uniforme e Mistura para Resultados Superiores
- Qual é a estrutura de um forno de soleira rotativa? Um Guia para Aquecimento Contínuo e Uniforme



















