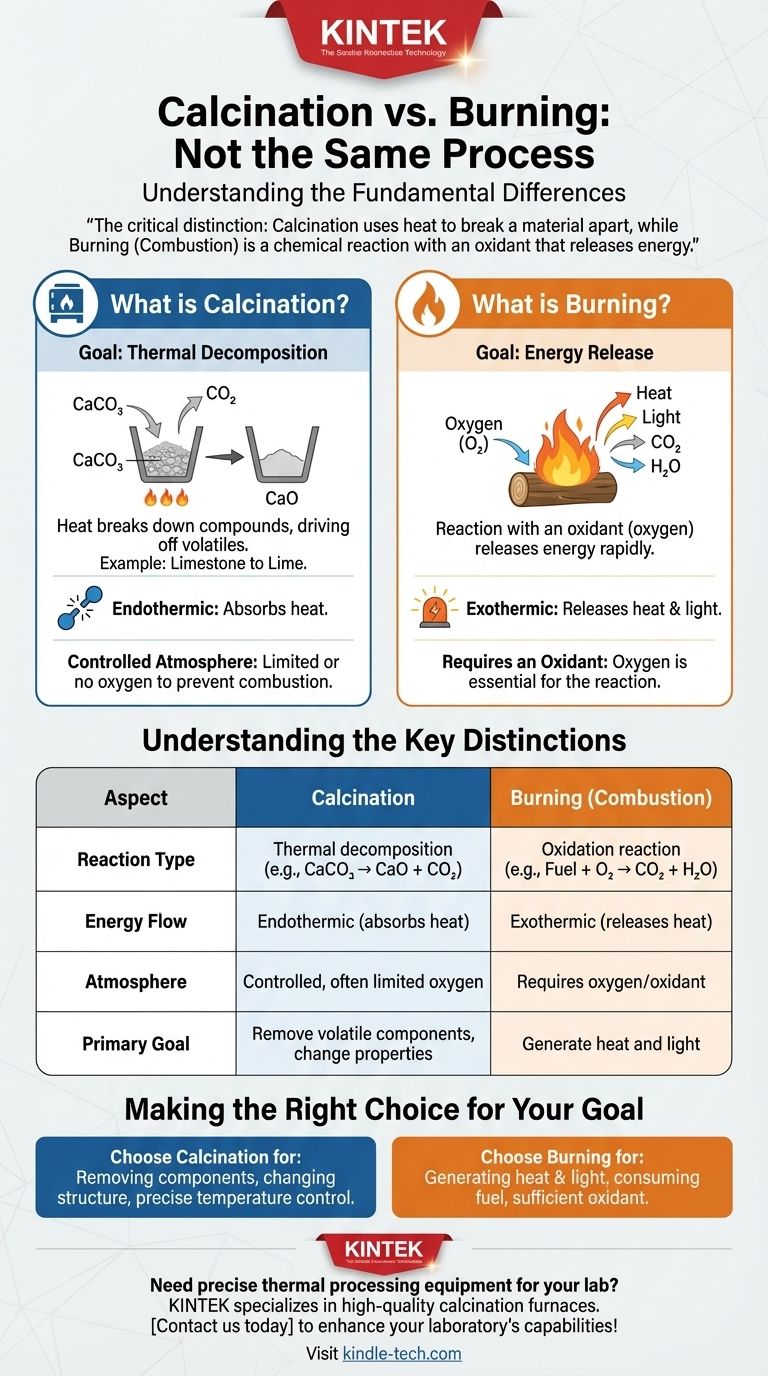
Ao contrário de uma concepção errada comum, a calcinação não é um processo de queima. Embora ambos envolvam altas temperaturas, são transformações químicas fundamentalmente diferentes. A calcinação é um processo de decomposição térmica, onde o calor é usado para quebrar um composto, muitas vezes para expelir um componente volátil como dióxido de carbono ou água.
A distinção crítica é esta: a calcinação usa calor para decompor um material, muitas vezes em uma atmosfera controlada, enquanto a queima (combustão) é uma reação química com um oxidante como o oxigênio que libera energia.

O que é Calcinação?
A calcinação é um processo de tratamento térmico preciso usado para alterar as propriedades químicas e físicas de um material. O termo deriva do latim calcinare, que significa 'queimar cal'.
O Objetivo: Decomposição Térmica
O propósito principal da calcinação é causar a decomposição térmica. O calor fornece a energia necessária para quebrar as ligações químicas dentro de uma substância, fazendo com que ela se separe em componentes mais simples.
Um Exemplo Comum: Calcário para Cal
A produção de cal a partir do calcário é o exemplo clássico. Quando o calcário (carbonato de cálcio, CaCO₃) é aquecido a uma alta temperatura, ele se decompõe.
Este processo libera gás dióxido de carbono (CO₂), deixando para trás a cal (óxido de cálcio, CaO), um componente crucial no cimento e outros materiais industriais.
O Papel de uma Atmosfera Controlada
Crucialmente, a calcinação frequentemente ocorre em uma atmosfera com pouco ou nenhum oxigênio. Isso é feito especificamente para prevenir a combustão e garantir que apenas a reação de decomposição desejada ocorra.
Como Isso é Diferente da Queima?
A queima, quimicamente conhecida como combustão, é uma reação exotérmica de alta temperatura entre um combustível e um oxidante, mais comumente oxigênio do ar.
A Necessidade de um Oxidante
Ao contrário da calcinação, a queima não pode acontecer sem um oxidante. Quando você queima madeira, os compostos orgânicos da madeira não estão apenas se decompondo; eles estão reagindo ativamente com o oxigênio.
O Objetivo: Liberação de Energia
O resultado principal da combustão é a rápida liberação de energia na forma de calor e luz. Embora também produza novas substâncias químicas (como cinzas, dióxido de carbono e vapor de água), a liberação de energia é sua característica definidora.
Compreendendo as Distinções Chave
Confundir esses dois processos pode levar a erros significativos no processamento de materiais, química e engenharia. As diferenças são claras e absolutas.
Tipo de Reação
A calcinação é uma reação de decomposição. Um único composto se decompõe em dois ou mais produtos mais simples (por exemplo, CaCO₃ → CaO + CO₂).
A combustão é uma reação de oxidação. Um combustível reage com um oxidante para formar novos produtos oxidados (por exemplo, CH₄ + 2O₂ → CO₂ + 2H₂O).
Fluxo de Energia
A calcinação é tipicamente um processo endotérmico. Requer uma entrada contínua de energia (calor) para sustentar a reação e quebrar as ligações químicas.
A combustão é um processo exotérmico. Uma vez iniciada, libera muito mais energia do que a necessária para iniciá-la, criando uma reação autossustentável.
Fazendo a Escolha Certa para o Seu Objetivo
Entender se você precisa calcinar ou queimar é fundamental para alcançar o resultado desejado em qualquer processo térmico.
- Se o seu foco principal é remover um componente específico de um sólido (como água ou CO₂) ou alterar sua estrutura cristalina: Você está realizando calcinação, onde o controle preciso da temperatura e o gerenciamento da atmosfera são críticos.
- Se o seu foco principal é gerar calor e luz consumindo um combustível: Você está realizando combustão, onde garantir um suprimento suficiente de um oxidante como o ar é a principal prioridade.
Distinguir entre esses dois processos fundamentais é essencial para controlar reações químicas e projetar materiais de forma eficaz.
Tabela Resumo:
| Aspecto | Calcinação | Queima (Combustão) |
|---|---|---|
| Tipo de Reação | Decomposição térmica | Reação de oxidação |
| Fluxo de Energia | Endotérmica (absorve calor) | Exotérmica (libera calor) |
| Atmosfera | Controlada, frequentemente com oxigênio limitado | Requer oxigênio/oxidante |
| Objetivo Principal | Remover componentes voláteis, alterar propriedades do material | Gerar calor e luz |
Precisa de equipamentos de processamento térmico precisos para o seu laboratório? A KINTEK é especializada em fornos de calcinação e equipamentos de laboratório de alta qualidade, projetados para decomposição térmica controlada. Nossas soluções garantem controle preciso de temperatura e gerenciamento de atmosfera para a transformação de materiais. Entre em contato conosco hoje para aprimorar as capacidades do seu laboratório!
Guia Visual
Produtos relacionados
- Forno Rotativo de Tubo com Múltiplas Zonas de Aquecimento Dividido
- Fornalha Rotativa de Tubo de Trabalho Contínuo Selada a Vácuo
- Fornalha Rotativa de Inclinação a Vácuo de Laboratório Fornalha de Tubo Rotativo
- Forno Rotativo Elétrico para Regeneração de Carvão Ativado
- Forno de Tubo de Quartzo para Processamento Térmico Rápido (RTP) de Laboratório
As pessoas também perguntam
- Qual é a função de um forno rotativo? Alcançar Processamento Térmico Uniforme e Contínuo
- Qual é a diferença entre pirólise rápida e pirólise ultrarrápida? Maximize o seu rendimento de bio-óleo
- Quais são as vantagens do processo de pirólise? Transformar Resíduos em Recursos Valiosos e Energia
- Quais são as vantagens de um forno rotativo? Obtenha Mistura, Aquecimento e Controle de Processo Superiores
- Qual é a temperatura mínima para pirólise? Controle sua Produção com Faixas de Temperatura Precisas
- O que é pirólise e qual a sua temperatura de operação? Um Guia para Converter Resíduos em Produtos Valiosos
- Qual é a diferença entre pirólise e combustão incompleta? O Papel Crítico do Oxigénio nos Processos Térmicos
- Quais são as fontes de óleo de pirólise? Desbloqueie Combustível a partir de Biomassa e Resíduos Plásticos



















