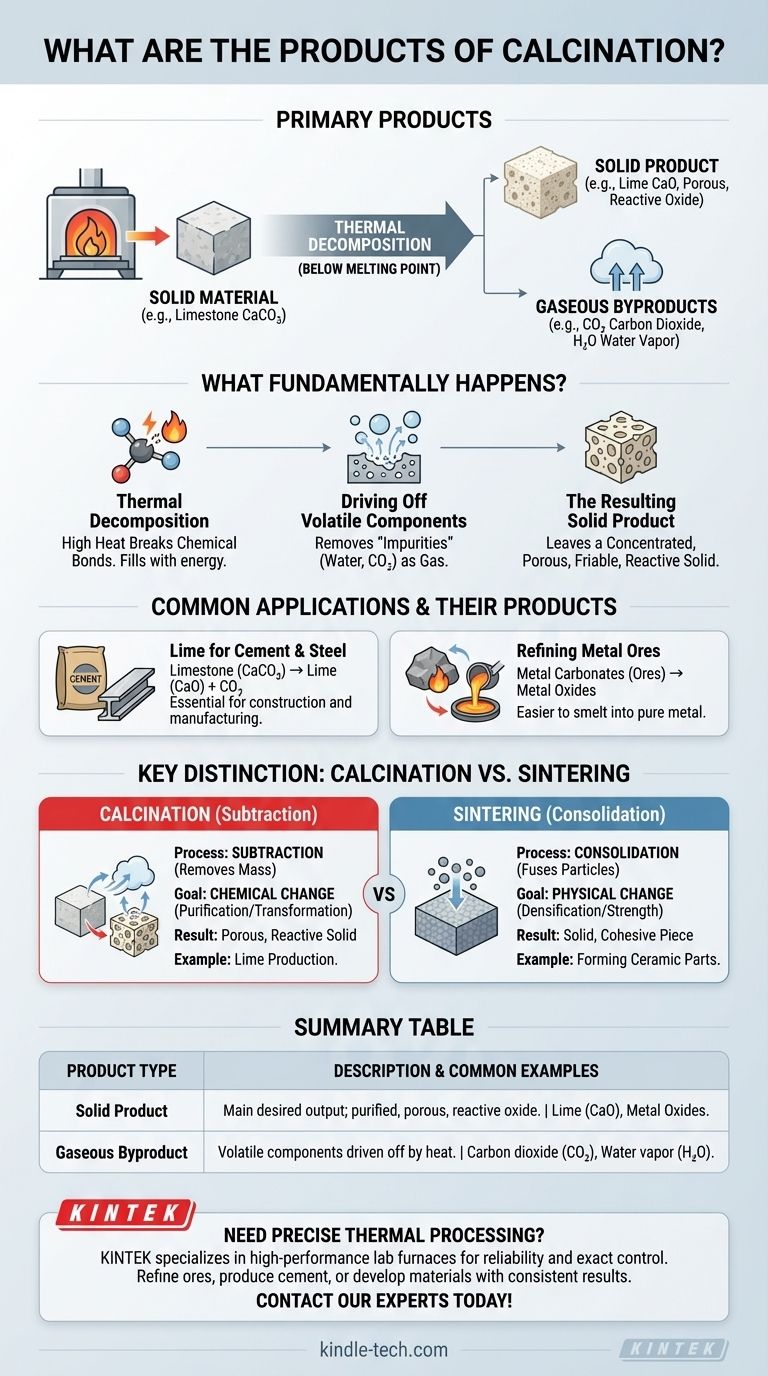
Em resumo, os principais produtos da calcinação são um material sólido que sofreu decomposição térmica e um ou mais subprodutos gasosos. Por exemplo, quando o calcário (carbonato de cálcio) é calcinado, ele se decompõe em cal sólida (óxido de cálcio) e gás dióxido de carbono, que é expelido pelo calor. O sólido resultante é o principal produto desejado.
A calcinação é fundamentalmente um processo de purificação e transformação. Seu objetivo é aquecer um material sólido para quebrá-lo quimicamente, expelindo componentes voláteis como água ou dióxido de carbono para produzir um sólido mais concentrado, poroso ou reativo.
O que fundamentalmente acontece durante a calcinação?
O Princípio da Decomposição Térmica
A calcinação é um processo de decomposição térmica, o que significa que usa calor intenso para decompor um composto em substâncias mais simples. Criticamente, isso ocorre a uma temperatura abaixo do ponto de fusão do material.
O processo força uma mudança química ao quebrar ligações. O exemplo mais comum é a decomposição de um carbonato em seu óxido e gás dióxido de carbono.
Expulsando Componentes Voláteis
O objetivo central da calcinação é remover substâncias "voláteis" que estão quimicamente ligadas dentro do sólido. A referência observa isso como a "remoção de impurezas".
Essas substâncias são tipicamente água (de minerais hidratados), dióxido de carbono (de carbonatos como o calcário) ou outros compostos decomponíveis. O aquecimento fornece a energia necessária para que esses componentes escapem como gás.
O Produto Sólido Resultante
O sólido que permanece é o produto principal. É frequentemente um óxido do material original, como a cal (CaO) a partir do calcário (CaCO₃).
À medida que o gás escapa, ele deixa para trás uma estrutura porosa e friável. É por isso que a referência descreve a cal resultante como estando em uma "condição facilmente pulverizável", o que aumenta sua área de superfície e reatividade química.
Aplicações Comuns e Seus Produtos
Produção de Cal para Cimento
O exemplo mais icônico é a produção de cal a partir do calcário. O produto sólido, a cal (óxido de cálcio), é um componente fundamental do cimento e também é usado na fabricação de aço e produção química.
Refino de Minérios Metálicos
A calcinação é uma etapa vital na metalurgia. Minérios como carbonato de zinco (smithsonita) ou carbonato de chumbo (cerussita) são aquecidos para convertê-los em seus respectivos óxidos.
Esses óxidos metálicos são o produto desejado porque são muito mais fáceis de reduzir (fundir) em metal puro em uma etapa subsequente.
Compreendendo a Distinção Chave: Calcinação vs. Sinterização
Calcinação: Um Processo de Subtração
A calcinação é um processo subtrativo. Ela remove massa do material na forma de gás.
Seu objetivo principal é a mudança química: purificar um material ou convertê-lo em um intermediário químico mais útil. O sólido resultante é frequentemente mais poroso e fisicamente mais fraco.
Sinterização: Um Processo de Consolidação
A sinterização, em contraste, é um processo de consolidação. Ela usa calor para fundir ou soldar pequenas partículas, aumentando a densidade e a resistência do material.
Nenhuma mudança química significativa ocorre, e nenhuma massa é perdida. O objetivo é transformar um pó em uma peça sólida e coesa, conforme observado na referência.
Fazendo a Escolha Certa para o Seu Objetivo
O processo que você escolher depende inteiramente do que você precisa que o material final faça.
- Se o seu foco principal é purificar um minério ou criar um intermediário químico como a cal: Você está olhando para a calcinação, onde o produto chave é o óxido sólido restante após a remoção dos gases voláteis.
- Se o seu foco principal é criar uma peça final forte e densa a partir de um pó: Você está olhando para a sinterização, onde o produto é uma massa sólida formada pela fusão de partículas sem alteração química.
Em última análise, entender se você precisa decompor um material ou consolidá-lo é a chave para selecionar o processo térmico correto.

Tabela de Resumo:
| Tipo de Produto | Descrição | Exemplos Comuns |
|---|---|---|
| Produto Sólido | O principal resultado desejado; um óxido purificado, poroso e reativo. | Cal (CaO) a partir do calcário (CaCO₃), óxidos metálicos a partir de minérios. |
| Subproduto Gasoso | Componentes voláteis expelidos pelo calor durante a decomposição. | Dióxido de carbono (CO₂), vapor de água (H₂O). |
Precisa de equipamentos de processamento térmico precisos para seus projetos de calcinação ou sinterização? A KINTEK é especializada em fornos de laboratório de alto desempenho e sistemas de processamento térmico projetados para confiabilidade e controle exato de temperatura. Se você está refinando minérios, produzindo cimento ou desenvolvendo novos materiais, nosso equipamento garante resultados consistentes e de alta qualidade. Contate nossos especialistas hoje para encontrar a solução perfeita para as necessidades do seu laboratório!
Guia Visual
Produtos relacionados
- Máquina de Forno de Pirólise de Forno Rotativo Elétrico Calciner Forno Rotativo Pequeno
- Forno de Mufla de 1700℃ para Laboratório
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de Alta Temperatura para Desgaseificação e Pré-Sinterização de Laboratório
- Forno de Mufla de 1800℃ para Laboratório
As pessoas também perguntam
- Qual é o significado da calcinação? Um Guia para Purificação e Extração de Metais
- Como se faz pirólise de biocarvão? Um Guia para Converter Biomassa em Carbono Estável
- Quais são as condições operacionais para a pirólise? Dominando a Temperatura, a Taxa de Aquecimento e o Tempo de Residência
- Como podemos converter resíduos plásticos em produtos úteis? Explorando a Reciclagem Mecânica vs. Química
- Para que serve um forno rotativo? Obtenha Uniformidade Térmica e Mistura Incomparáveis
- Qual é o mecanismo operacional de um forno de pirólise de alta temperatura? Guia especializado para carbonização de casca de coco
- Qual é o propósito de um forno rotativo? Obtenha Uniformidade de Aquecimento Inigualável para Pós e Peças
- Quais são as desvantagens de um forno de velocidade variável? Custo Mais Alto vs. Conforto Superior



















