Em resumo, uma atmosfera redutora é um ambiente gasoso controlado onde o oxigênio foi intencionalmente removido e substituído por gases que previnem a oxidação e promovem ativamente a redução química. Este tipo de atmosfera é rico em "agentes redutores" como hidrogênio (H₂), monóxido de carbono (CO) ou sulfeto de hidrogênio (H₂S), que estão quimicamente ansiosos para doar elétrons e remover oxigênio de outros materiais.
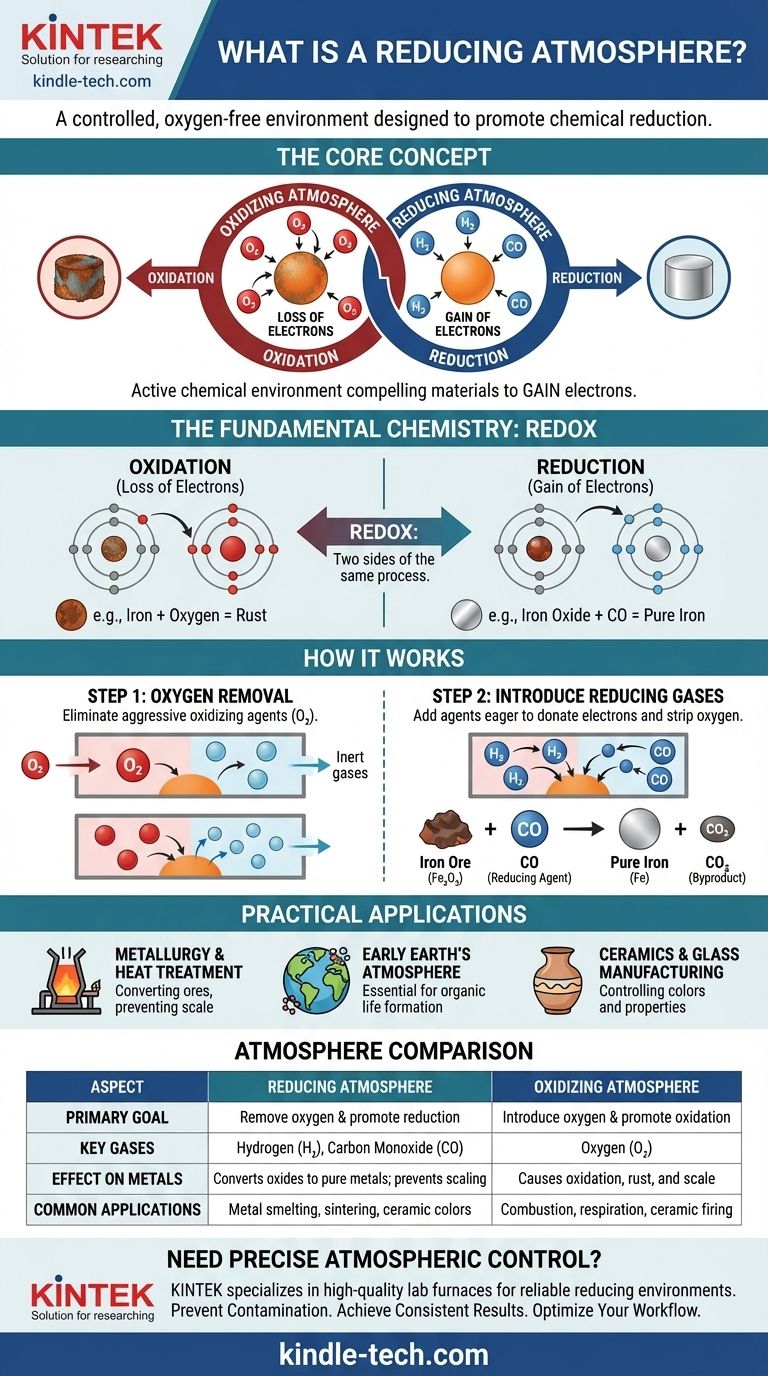
Uma atmosfera redutora não se trata apenas da ausência de oxigênio; é um ambiente químico ativo projetado para forçar uma reação específica. Ela funciona criando um excedente de elétrons, compelindo os materiais dentro dela a ganhar esses elétrons e retornar a um estado menos oxidado.

A Química Fundamental em Jogo
Para realmente entender uma atmosfera redutora, você deve primeiro compreender o princípio químico fundamental em que ela se baseia: oxidação e redução. Estes são dois lados da mesma moeda, um processo frequentemente chamado de "redox".
Compreendendo a Oxidação e a Redução
Oxidação é a perda de elétrons. Um exemplo clássico é a ferrugem do ferro. O oxigênio no ar retira elétrons dos átomos de ferro, formando óxido de ferro (ferrugem). O ferro é "oxidado".
Redução é o ganho de elétrons. É o oposto químico da oxidação. Uma atmosfera redutora facilita este processo criando um ambiente onde os átomos são forçados a absorver elétrons.
Pense nisso como um cabo de guerra químico por elétrons. Um agente oxidante, como o oxigênio, é forte e retira elétrons de outros materiais. Um agente redutor, como o hidrogênio, é generoso e doa elétrons para outros materiais.
O Papel da Remoção de Oxigênio
O primeiro e mais crítico passo na criação de uma atmosfera redutora é a remoção do oxigênio livre (O₂) e outros gases oxidantes.
O oxigênio é um agente oxidante altamente agressivo. Sua presença torna quase impossível realizar uma reação de redução, pois ele retirará implacavelmente elétrons de qualquer fonte disponível. Removê-lo impede que essa oxidação indesejada ocorra.
A Função dos Gases Redutores
Simplesmente remover o oxigênio cria uma atmosfera neutra, ou inerte. Para torná-la uma atmosfera redutora, gases específicos são introduzidos.
Esses gases — tipicamente hidrogênio (H₂) ou monóxido de carbono (CO) — atuam como poderosos agentes redutores. Eles têm uma afinidade mais forte pelo oxigênio do que muitos outros elementos, o que significa que eles "roubarão" ativamente átomos de oxigênio de compostos como óxidos metálicos.
Por exemplo, quando o minério de ferro (óxido de ferro, Fe₂O₃) é aquecido em um forno com monóxido de carbono, o CO remove o oxigênio do ferro, deixando para trás ferro líquido puro e criando dióxido de carbono (CO₂) como subproduto. O minério de ferro foi "reduzido" a ferro.
Aplicações Práticas e Contexto
As atmosferas redutoras não são apenas um conceito teórico; elas são uma ferramenta crítica em muitos processos industriais e científicos onde é necessário um controle químico preciso.
Metalurgia e Tratamento Térmico
Esta é a aplicação mais comum. Os altos-fornos usam uma atmosfera redutora rica em monóxido de carbono para transformar minérios metálicos em metais puros. Também é usada em recozimento e sinterização para prevenir a formação de óxidos (carepa) na superfície dos metais durante o processamento em alta temperatura.
Atmosfera da Terra Primitiva
Cientistas teorizam que a atmosfera primordial da Terra era redutora, contendo metano, amônia e vapor d'água, mas praticamente nenhum oxigênio livre. Este ambiente foi essencial para a formação das moléculas orgânicas complexas que eventualmente levaram à vida.
Fabricação de Cerâmica e Vidro
A atmosfera dentro de um forno tem um efeito profundo no produto final. Uma atmosfera redutora pode ser usada para criar cores e propriedades específicas em esmaltes cerâmicos e vidro, alterando o estado de oxidação dos óxidos metálicos usados como corantes. Por exemplo, o óxido de cobre produz verde em uma queima oxidante, mas um vermelho profundo em uma queima redutora.
Compreendendo as Trocas: Oxidante vs. Redutora
O oposto de uma atmosfera redutora é uma atmosfera oxidante, que é rica em oxigênio. A atmosfera atual do nosso planeta é um excelente exemplo.
A Atmosfera Oxidante
Uma atmosfera oxidante promove a perda de elétrons. É essencial para processos como combustão (queima) e respiração celular, mas é destrutiva em outros contextos, causando corrosão, deterioração e degradação.
Por Que o Controle Atmosférico é Crítico
A escolha entre uma atmosfera redutora, inerte ou oxidante é determinada inteiramente pelo resultado desejado. Usar a errada não é apenas ineficiente; pode ser catastrófico para um processo.
Tentar fundir metal em um ambiente rico em oxigênio falharia, produzindo mais óxidos e carepa. Por outro lado, queimar uma cerâmica que requer oxidação em uma atmosfera redutora resultaria em cores incorretas e imprevisíveis.
Como Aplicar Este Conhecimento
Compreender o propósito de uma atmosfera específica resume-se a identificar a transformação química desejada.
- Se o objetivo principal é prevenir a degradação: Uma atmosfera inerte ou redutora é usada para remover o oxigênio, o principal agente de corrosão e mancha.
- Se o objetivo principal é transformar um material de um óxido para sua forma pura: Uma atmosfera redutora é necessária para remover ativamente átomos de oxigênio do material (por exemplo, transformar minério em metal).
- Se o objetivo principal é controlar as propriedades finais de um composto: O equilíbrio entre oxidação e redução é usado para manipular o estado eletrônico dos elementos, controlando assim resultados como a cor em cerâmicas ou a condutividade em semicondutores.
Em última análise, saber se uma atmosfera é projetada para doar ou aceitar elétrons é a chave para prever e controlar os resultados químicos.
Tabela Resumo:
| Aspecto | Atmosfera Redutora | Atmosfera Oxidante |
|---|---|---|
| Objetivo Principal | Remover oxigênio e promover a redução (ganho de elétrons) | Introduzir oxigênio e promover a oxidação (perda de elétrons) |
| Gases Chave | Hidrogênio (H₂), Monóxido de Carbono (CO) | Oxigênio (O₂) |
| Efeito nos Metais | Converte óxidos metálicos em metais puros; previne a formação de carepa | Causa oxidação, levando à ferrugem e carepa |
| Aplicações Comuns | Fundição de metais, recozimento, sinterização, esmaltes cerâmicos específicos | Combustão, respiração, queima de certas cerâmicas |
Precisa de Controle Atmosférico Preciso para Seus Processos de Laboratório?
Seja você sinterizando metais, desenvolvendo esmaltes cerâmicos especializados ou conduzindo pesquisas que exigem um ambiente livre de oxigênio, o equipamento certo é crítico. A KINTEK é especializada no fornecimento de fornos e reatores de laboratório de alta qualidade projetados para controle atmosférico preciso, incluindo a criação de ambientes redutores confiáveis.
Nós ajudamos você a:
- Prevenir Contaminação: Garanta que seus materiais não sejam degradados por oxidação indesejada.
- Alcançar Resultados Consistentes: Obtenha as transformações químicas precisas que você precisa, lote após lote.
- Otimizar Seu Fluxo de Trabalho: Com equipamentos projetados para confiabilidade e facilidade de uso.
Pronto para aprimorar as capacidades do seu laboratório? Entre em contato com a KINTEK hoje para discutir suas necessidades específicas de laboratório e como nossas soluções podem impulsionar seu sucesso.
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno Rotativo de Tubo com Múltiplas Zonas de Aquecimento Dividido
As pessoas também perguntam
- Como é utilizada uma atmosfera redutora nas operações de fundição? Guia Essencial para a Redução de Minério de Ferro e Refino de Metais
- Como um reator de tubo de quartzo e um forno de atmosfera colaboram na pirólise de Co@NC? Síntese de Precisão Mestra
- Por que um sistema de controle de atmosfera fornecendo nitrogênio de alta pureza é essencial para processos de torrefação de biomassa?
- O argônio reage com alguma coisa? Descubra o Poder do Gás Inerte Definitivo
- Por que os pellets de UO2 devem passar por tratamento térmico em um forno com atmosfera redutora? Garanta a Precisão Experimental
- Qual o papel de uma manta de gás argônio de alta pureza nos testes de corrosão em alta temperatura? Garanta a Precisão Exata dos Dados
- Como um forno de recozimento de alta temperatura facilita a ativação do carbono? Desbloqueie uma área superficial superior com KOH
- Qual é o papel de um Forno de Atmosfera na preparação de óxido de grafeno à base de lignina? Perspectivas Chave de Carbonização



















