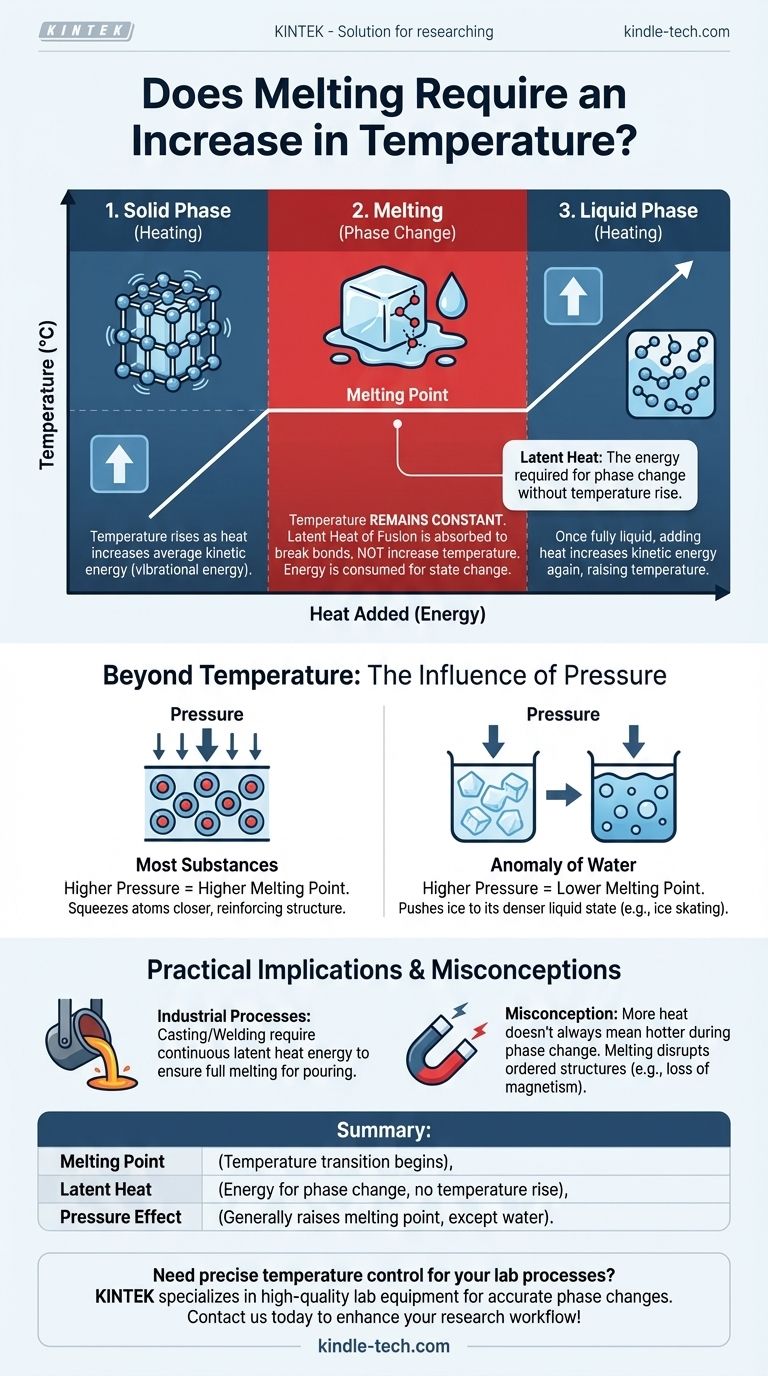
A relação entre calor, temperatura e fusão é frequentemente mal compreendida. Para fundir um sólido, você deve adicionar energia na forma de calor. Esse processo primeiro eleva a temperatura da substância até que ela atinja seu ponto de fusão específico. No entanto, durante a transição real de sólido para líquido, a temperatura permanece constante, mesmo com o fornecimento de mais calor.
Embora uma substância precise primeiro ser aquecida até seu ponto de fusão, o processo de fusão em si ocorre a uma temperatura constante. A energia adicionada, conhecida como calor latente, é usada para quebrar as ligações da estrutura sólida, e não para aumentar a temperatura geral da substância.

A Física de uma Mudança de Fase
Para entender por que a fusão ocorre a uma temperatura constante, devemos primeiro distinguir entre calor e temperatura. Eles estão relacionados, mas não são a mesma coisa.
O que é Temperatura?
Temperatura é uma medida da energia cinética média dos átomos ou moléculas dentro de uma substância. Em um sólido, esses átomos estão presos em uma estrutura fixa, como uma rede cristalina, mas estão vibrando constantemente. À medida que você adiciona calor, você aumenta essa energia vibracional, que medimos como um aumento na temperatura.
Atingindo o Ponto de Fusão
À medida que você continua a adicionar calor, os átomos vibram com mais e mais violência. Eventualmente, eles atingem um nível de energia em que as vibrações são fortes o suficiente para começar a quebrar as ligações rígidas que os mantêm em suas posições fixas. Essa temperatura específica é o ponto de fusão.
O Papel do Calor Latente
No ponto de fusão, ocorre uma mudança crítica. Qualquer energia de calor adicional que você forneça — conhecida como calor latente de fusão — é agora usada exclusivamente para quebrar as ligações restantes da estrutura sólida. Ela não é usada para fazer as moléculas vibrarem mais rápido.
Como a energia está sendo consumida para mudar o estado da substância (de sólido para líquido) em vez de aumentar sua energia cinética, a temperatura permanece perfeitamente constante até que todo o sólido tenha se transformado em líquido.
O Estado Líquido
Assim que o último sólido derrete, a substância está totalmente no estado líquido. A partir deste ponto, qualquer calor adicional que você adicionar aumentará novamente a energia cinética das moléculas, fazendo com que a temperatura do líquido suba.
Além da Temperatura: A Influência da Pressão
A temperatura não é o único fator que governa a fusão. A pressão desempenha um papel crucial e, às vezes, contraintuitivo.
Como a Pressão Afeta a Fusão
Para a maioria das substâncias, o aumento da pressão externa eleva o ponto de fusão. Alta pressão comprime fisicamente os átomos, reforçando a estrutura sólida. Isso significa que mais energia (e, portanto, uma temperatura mais alta) é necessária para quebrar as ligações e permitir que a substância derreta.
A Anomalia da Água
A água é uma exceção notável. A forma sólida da água (gelo) é menos densa do que sua forma líquida. O aumento da pressão sobre o gelo o empurra para seu estado mais denso — água líquida. Isso significa que sob alta pressão, o gelo pode derreter a uma temperatura abaixo de seu ponto de fusão padrão de 0°C (32°F). Este princípio contribui para a forma como a lâmina de um patim de gelo desliza sobre o gelo.
Implicações Práticas e Conceitos Errôneos
Compreender este processo não é apenas acadêmico; tem consequências diretas na ciência e na engenharia.
Conceito Erróneo: Mais Calor Sempre Significa Mais Quente
O equívoco mais comum é que adicionar calor continuamente sempre tornará algo mais quente. Durante uma mudança de fase, como fusão ou ebulição, isso está incorreto. A entrada de energia está realizando o trabalho de mudar o estado do material, não de aumentar sua temperatura.
Por Que Isso Importa na Prática
Em processos industriais como fundição ou soldagem de metais, este princípio é fundamental. Um forno deve não apenas levar um metal ao seu ponto de fusão, mas também fornecer uma quantidade significativa e contínua de energia adicional (o calor latente) para garantir que toda a massa se torne totalmente líquida para a vazamento. Da mesma forma, a fusão interrompe a estrutura atômica ordenada dos materiais. É por isso que aquecer uma peça de aço magnetizada além de um certo ponto (sua temperatura de Curie, que está relacionada, mas é distinta de seu ponto de fusão) fará com que ela perca seu magnetismo, à medida que os domínios magnéticos organizados são desfeitos.
Fazendo a Escolha Certa para o Seu Objetivo
Sua aplicação determina qual parte deste processo é mais importante para você.
- Se o seu foco principal é a compreensão da física básica: Lembre-se de que a temperatura é constante durante uma mudança de fase; a energia adicionada é chamada de calor latente e é usada para mudar o estado.
- Se o seu foco principal é ciência dos materiais ou engenharia: Reconheça que fundir completamente uma substância requer uma entrada de energia precisa e contínua, mesmo depois que ela atingiu sua temperatura de fusão.
- Se você está considerando efeitos ambientais: Esteja ciente de que a pressão pode alterar significativamente o ponto de fusão de uma substância, elevando-o para a maioria dos materiais, mas diminuindo-o para uma exceção importante como a água.
Compreender essa distinção entre temperatura e energia térmica é fundamental para controlar e prever o comportamento de qualquer material.
Tabela de Resumo:
| Conceito | Descrição |
|---|---|
| Ponto de Fusão | Temperatura na qual um sólido começa a transição para líquido. |
| Calor Latente de Fusão | Energia absorvida durante a fusão sem alteração de temperatura. |
| Efeito da Pressão | Alta pressão eleva o ponto de fusão (exceto para a água, que o diminui). |
| Aplicação Prática | Crítico para processos industriais como fundição e soldagem de metais. |
Precisa de controle preciso de temperatura para seus processos de laboratório? A KINTEK é especializada em equipamentos de laboratório de alta qualidade, incluindo fornos e sistemas de aquecimento, projetados para lidar com mudanças de fase como a fusão com precisão. Se você está trabalhando com metais, polímeros ou outros materiais, nossas soluções garantem gerenciamento de energia eficiente e resultados consistentes. Entre em contato conosco hoje para explorar como nossos equipamentos de laboratório podem aprimorar sua pesquisa ou fluxo de trabalho de produção!
Guia Visual
Produtos relacionados
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de 1800℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno Muffle de 1400℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é o processo de tratamento térmico mais comum para aumentar a dureza? Dominando o Endurecimento e Revenimento do Aço
- Como selecionar a melhor bomba de palhetas rotativas para necessidades específicas? Combine os requisitos da sua aplicação
- Qual é a temperatura e o tempo para a incineração? Obtenha Resultados Precisos com os Parâmetros Certos
- Como o GIA identifica diamantes cultivados em laboratório? Descubra a Ciência por Trás da Verificação da Origem do Diamante
- O que é o efeito de sinterização? Transforme Pó em Peças Duráveis e de Alto Desempenho
- Qual é o princípio do forno? Dominando o Calor com Resistência, Indução e Vácuo
- Quais são os fatores que afetam a resistência de uma junta soldada por brasagem? Domine as 4 Chaves para uma União Perfeita
- Quais são as alternativas ao alongamento de coroa? Explore a Extrusão Ortodôntica e a Gengivectomia



















