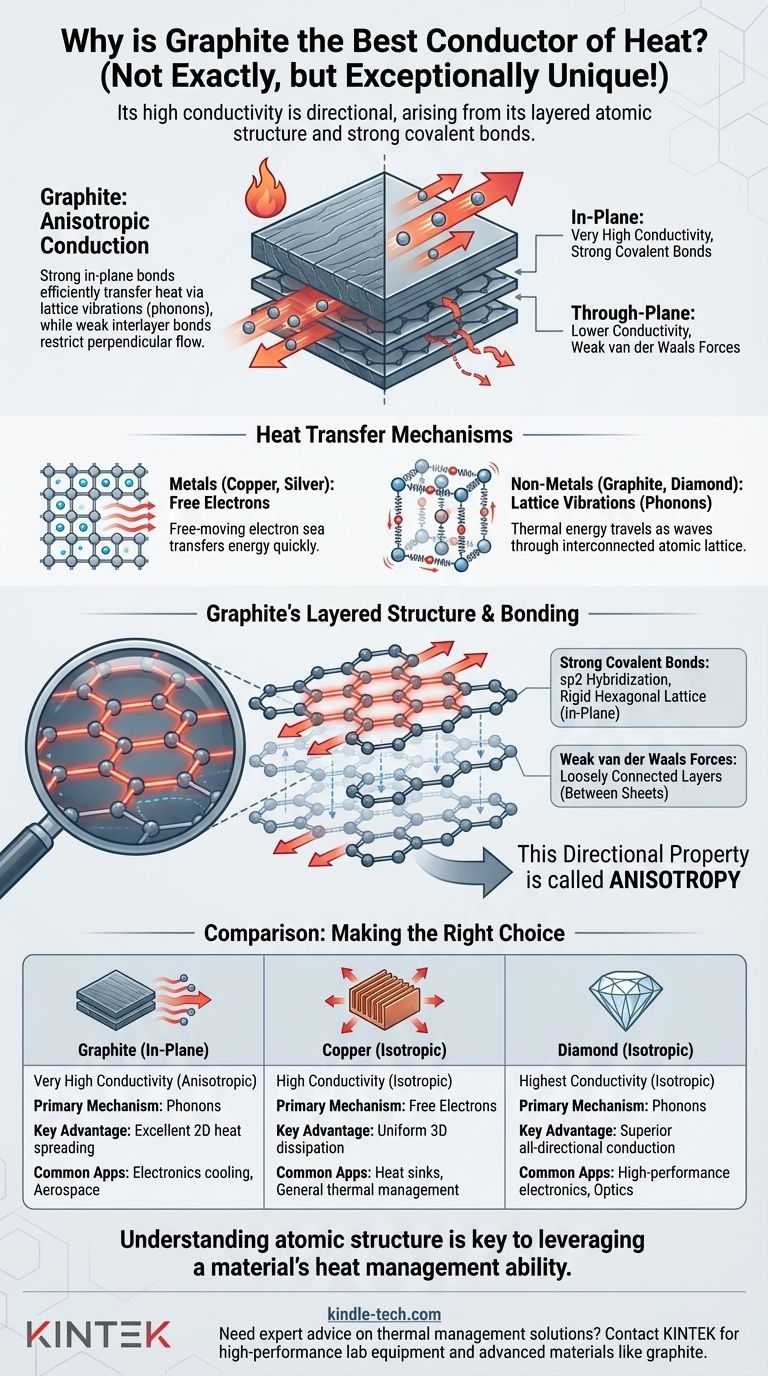
Embora seja um excelente condutor térmico, o grafite não é, na verdade, o melhor. Sua reputação vem de sua capacidade única de conduzir calor excepcionalmente bem em direções específicas, muitas vezes rivalizando com metais como o cobre. Essa alta condutividade é um resultado direto da estrutura atômica em camadas do grafite e das fortes ligações químicas dentro dessas camadas.
A alta condutividade térmica do grafite não é um fato simples, mas uma propriedade direcional. Ela surge de fortes ligações atômicas no plano que transferem calor eficientemente via vibrações da rede (fônons), enquanto as ligações fracas entre suas camadas restringem o fluxo de calor na direção perpendicular. Esse comportamento direcional, conhecido como anisotropia, é a chave para entender seu desempenho térmico.

Como o Calor se Move Através de um Sólido
Para entender o grafite, precisamos primeiro entender os dois principais mecanismos de transferência de calor em um material sólido.
O Papel dos Elétrons Livres
Em metais como prata, cobre e alumínio, os elétrons externos dos átomos não estão ligados a um único átomo. Eles formam um "mar" de elétrons de movimento livre.
Quando uma parte do metal é aquecida, esses elétrons ganham energia cinética e se movem rapidamente, colidindo com outros elétrons e átomos para transferir rapidamente essa energia por todo o material. Este é um processo altamente eficiente, tornando os metais excelentes condutores térmicos.
O Papel das Vibrações da Rede (Fônons)
Em não-metais como grafite e diamante, há muito poucos elétrons livres. O calor é transferido principalmente através de vibrações da rede.
Pense nos átomos em um sólido como estando conectados por molas. Aquecer uma extremidade faz com que os átomos ali vibrem mais intensamente. Essas vibrações viajam através da rede atômica interconectada como ondas, semelhante a uma onda sonora. Essas ondas de energia térmica são chamadas de fônons. Quanto mais fortes e rígidas as "molas" (ligações atômicas), mais eficientemente os fônons podem viajar.
A Estrutura Única do Grafite
As propriedades térmicas do grafite são uma consequência direta de seu arranjo atômico. É um alótropo de carbono, o que significa que tem os mesmos átomos que o diamante, mas eles estão ligados de forma diferente.
Uma História de Duas Ligações: Fortes vs. Fracas
O grafite é composto por folhas empilhadas de átomos de carbono. Cada folha é uma camada de um átomo de espessura do que hoje chamamos de grafeno.
Dentro de cada folha, cada átomo de carbono está ligado a outros três por ligações covalentes extremamente fortes (hibridização sp2). Essas ligações formam uma rede hexagonal que é incrivelmente rígida e estável.
No entanto, as ligações entre essas folhas são forças de van der Waals muito fracas. As camadas não estão rigidamente conectadas e podem facilmente deslizar umas sobre as outras, razão pela qual o grafite é escorregadio ao toque e é usado como lubrificante.
Condução no Plano vs. Através do Plano
Essa estrutura de dupla ligação cria dois caminhos muito diferentes para o calor.
Quando o calor é aplicado ao longo do plano de uma folha de grafeno (direção no plano), as fortes ligações covalentes permitem que os fônons viajem com extrema velocidade e mínima resistência. Isso resulta em condutividade térmica excepcionalmente alta nessa direção.
Quando o calor deve viajar de uma folha para outra (direção através do plano), ele precisa atravessar a fraca lacuna de van der Waals. Os fônons não se transferem eficientemente através dessa ligação fraca, levando a uma condutividade térmica muito menor – muitas vezes 100 vezes menor do que o valor no plano.
Anisotropia: A Característica Definidora
Essa dependência direcional de uma propriedade é chamada de anisotropia. O grafite é altamente anisotrópico. É um condutor fantástico em duas dimensões (ao longo das folhas), mas um condutor relativamente pobre na terceira dimensão (entre as folhas).
É por isso que um bloco de grafite ficará quente de um lado quase instantaneamente se você aquecer o outro lado, mas levará muito mais tempo para a parte superior esquentar se você aquecer a parte inferior.
Compreendendo as Trocas: Grafite vs. Outros Condutores
Corrigindo a premissa inicial, é crucial ver onde o grafite se posiciona em relação a outros materiais.
Comparação com o Diamante
O diamante, outro alótropo de carbono, é o melhor condutor térmico natural conhecido. Seus átomos de carbono estão todos conectados por fortes ligações covalentes (hibridização sp3) em uma rede tetraédrica rígida e tridimensional.
Não há ligações fracas. Os fônons podem viajar com incrível eficiência em qualquer direção. Isso torna o diamante um condutor isotrópico (uniforme em todas as direções) e superior à melhor condutividade do grafite.
Comparação com Metais (Prata e Cobre)
Os melhores condutores metálicos, como prata e cobre, se beneficiam da transferência de calor altamente eficiente dos elétrons livres.
Embora a condutividade térmica no plano do grafite pirolítico de alta qualidade possa exceder a do cobre, os metais têm a vantagem de serem isotrópicos. Eles conduzem o calor igualmente bem em todas as direções, tornando-os mais previsíveis e adequados para aplicações onde o calor precisa se dissipar uniformemente.
Fazendo a Escolha Certa para Sua Aplicação
A escolha de um material térmico depende inteiramente do objetivo de engenharia específico.
- Se seu foco principal é a dissipação de calor unidirecional: Folhas de grafite pirolítico de alta pureza são uma escolha excepcional para mover o calor rapidamente de uma fonte (como uma CPU) ao longo de um único plano.
- Se seu foco principal é a dissipação de calor uniforme e multidirecional: Materiais isotrópicos como cobre, alumínio ou diamante são superiores para tarefas onde o calor precisa ser conduzido uniformemente em todas as direções.
- Se seu foco principal é equilibrar custo, peso e desempenho: Alumínio e compósitos de grafite especializados são frequentemente os materiais de escolha para gerenciamento térmico de uso geral em eletrônicos e aeroespacial.
Em última análise, compreender a estrutura atômica e as ligações de um material é a chave para prever e alavancar sua capacidade de gerenciar o calor.
Tabela Resumo:
| Propriedade | Grafite (No Plano) | Cobre | Diamante |
|---|---|---|---|
| Condutividade Térmica | Muito Alta (Anisotrópica) | Alta (Isotrópica) | Mais Alta (Isotrópica) |
| Mecanismo Primário | Vibrações da Rede (Fônons) | Elétrons Livres | Vibrações da Rede (Fônons) |
| Vantagem Chave | Excelente dissipação de calor 2D | Dissipação 3D uniforme | Condução superior em todas as direções |
| Aplicações Comuns | Resfriamento de eletrônicos, aeroespacial | Dissipadores de calor, gerenciamento térmico geral | Eletrônicos de alto desempenho, óptica |
Precisa de aconselhamento especializado em soluções de gerenciamento térmico para o seu laboratório? A KINTEK é especializada em equipamentos e consumíveis de laboratório de alto desempenho, incluindo materiais avançados como grafite para controle térmico preciso. Se você está desenvolvendo eletrônicos de próxima geração ou precisa de gerenciamento de calor confiável em pesquisa, nossa equipe pode ajudá-lo a selecionar os materiais ideais para sua aplicação específica. Entre em contato conosco hoje para otimizar o desempenho térmico do seu laboratório!
Guia Visual
Produtos relacionados
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Forno de Grafitação a Vácuo de Ultra-Alta Temperatura de Grafite
- Forno de Grafitação Contínua a Vácuo de Grafite
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é o uso do forno de grafite? Alcançar processamento de temperatura extrema para materiais avançados
- Quais são as interferências do forno de grafite? Supere Problemas de Matriz e Espectrais para GFAAS Preciso
- O que é o processo de carbonização? Um Guia Completo para Converter Biomassa em Carvão Vegetal
- Como o grafite sintético é fabricado? Um Mergulho Profundo no Processo de Alta Temperatura
- O que é a técnica de forno de grafite? Alcance Temperaturas Extremas para Materiais Avançados
- O que é um forno de carbonização? Transforme Biomassa Residual em Carvão Valioso de Forma Eficiente
- Qual é a desvantagem do forno de grafite? Gerenciando Riscos de Reatividade e Contaminação
- Por que um forno de grafite é mais sensível do que uma chama? Desvendando a Análise de Traços Superior



















