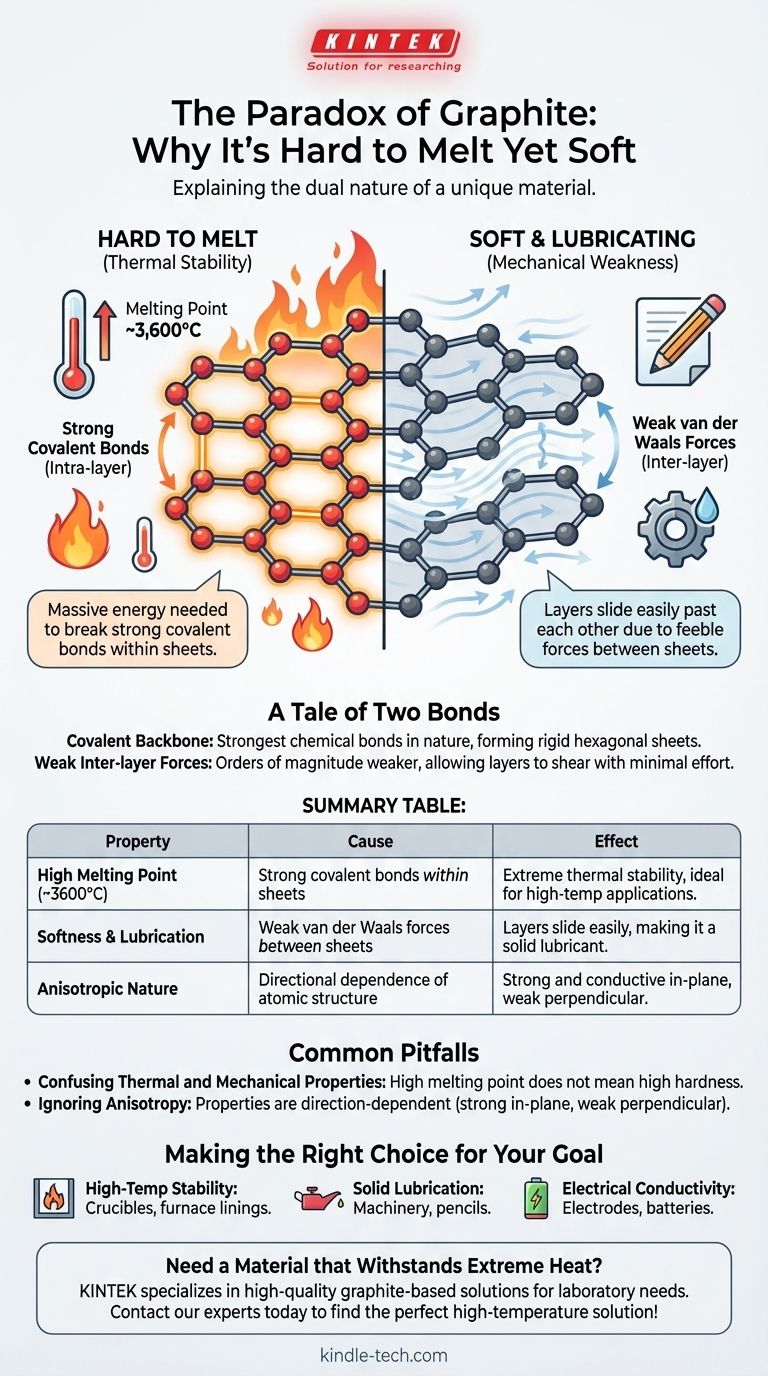
O paradoxo do grafite reside na sua dupla natureza: é um dos materiais mais macios conhecidos, mas possui um dos pontos de fusão mais altos. Este comportamento deriva da sua estrutura atômica única, onde os átomos de carbono são mantidos por ligações covalentes imensamente fortes dentro de folhas planas, exigindo uma quantidade massiva de energia para quebrar e derreter a substância.
As propriedades do grafite são uma história de duas forças. A força extrema das ligações covalentes dentro das suas camadas atômicas dita o seu alto ponto de fusão, enquanto a profunda fraqueza das forças entre essas camadas explica por que ele é macio ao toque e atua como lubrificante.

Uma História de Duas Ligações: A Fonte da Força do Grafite
A resistência do grafite ao derretimento está enraizada na forma fundamental como seus átomos de carbono estão conectados. Esta arquitetura interna é incrivelmente robusta.
A Espinha Dorsal Covalente
Cada átomo de carbono em uma camada de grafite está ligado a outros três por ligações covalentes. Essas ligações, que envolvem o compartilhamento de elétrons entre átomos, estão entre os tipos mais fortes de ligações químicas na natureza.
Para derreter uma substância, é preciso fornecer energia térmica suficiente para quebrar as ligações que mantêm seus átomos em uma estrutura sólida e fixa. Como as ligações covalentes do grafite são tão fortes, a energia necessária para rompê-las é imensa, resultando em um ponto de fusão de cerca de 3.600°C (6.500°F).
As Folhas Hexagonais
Esses átomos ligados covalentemente formam vastas folhas planas dispostas em uma rede hexagonal, semelhante a um favo de mel. Você pode pensar em cada folha como uma única camada do material maravilhoso, o grafeno.
Dentro dessas folhas, a estrutura é rígida e excepcionalmente estável. A força não está apenas em uma direção; ela é distribuída por todo o plano bidimensional.
Resolvendo o Paradoxo: Por Que Ele Também é Macio?
A explicação para a maciez do grafite não é encontrada dentro de suas fortes folhas atômicas, mas no espaço entre elas.
Forças Intercamadas Fracas
Embora os átomos dentro de uma folha estejam fortemente ligados, as próprias folhas são empilhadas umas sobre as outras com muito pouco as mantendo unidas. Elas são atraídas apenas por forças intermoleculares fracas conhecidas como forças de van der Waals.
Essas forças são ordens de magnitude mais fracas do que as ligações covalentes dentro das folhas.
As Camadas Deslizantes
Como a atração entre as camadas é tão fraca, as folhas podem facilmente deslizar umas sobre as outras com o mínimo esforço. Essa ação de deslizamento é o que percebemos como maciez e o que torna o grafite um excelente lubrificante sólido.
Quando você escreve com um lápis, você está simplesmente cortando milhares dessas camadas fracamente conectadas e depositando-as no papel.
Intra-camada vs. Inter-camada
Esta distinção é a chave para entender o grafite. As forças intra-camada (ligações covalentes) são incrivelmente fortes, conferindo ao grafite sua estabilidade térmica. As forças inter-camada (van der Waals) são incrivelmente fracas, conferindo-lhe maciez mecânica.
Armadilhas Comuns a Evitar
Compreender o grafite significa evitar a simplificação excessiva comum de que um material é "forte" ou "fraco". Suas propriedades dependem muito do contexto e da direção.
Confundindo Propriedades Térmicas e Mecânicas
É um erro comum supor que um alto ponto de fusão deve correlacionar-se com alta dureza mecânica. O grafite é o contra-exemplo clássico.
Sua estabilidade térmica (resistência ao derretimento) é governada por suas fortes ligações covalentes. Suas propriedades mecânicas (maciez e resistência ao cisalhamento) são governadas por suas fracas forças intercamadas.
Ignorando a Anisotropia
O grafite é um material altamente anisotrópico, o que significa que suas propriedades dependem da direção.
É extremamente forte e conduz bem o calor e a eletricidade ao longo do plano de suas folhas atômicas. No entanto, é mecanicamente fraco e um mau condutor perpendicularmente a essas folhas.
Fazendo a Escolha Certa para o Seu Objetivo
Essa dupla natureza torna o grafite um material excepcionalmente versátil, mas sua aplicação deve estar alinhada com suas propriedades direcionais específicas.
- Se o seu foco principal é a estabilidade em altas temperaturas: O grafite é uma excelente escolha para aplicações como cadinhos ou revestimentos de fornos, pois suas fortes ligações covalentes resistem à degradação térmica.
- Se o seu foco principal é a lubrificação sólida: As camadas fracamente ligadas e deslizantes do grafite o tornam ideal para reduzir o atrito em máquinas, fechaduras ou como o "grafite" em lápis.
- Se o seu foco principal é a condutividade elétrica: A estrutura permite que os elétrons se movam livremente ao longo das folhas, tornando o grafite um material útil para eletrodos, baterias e escovas em motores elétricos.
Reconhecer que as propriedades macroscópicas de um material são um resultado direto de sua estrutura atômica é a chave para resolver qualquer desafio de engenharia.
Tabela Resumo:
| Propriedade | Causa | Efeito |
|---|---|---|
| Alto Ponto de Fusão (~3600°C) | Fortes ligações covalentes dentro das folhas atômicas | Estabilidade térmica extrema, ideal para aplicações de alta temperatura |
| Maciez & Lubrificação | Fracas forças de van der Waals entre as folhas | As camadas deslizam facilmente, tornando-o um lubrificante sólido |
| Natureza Anisotrópica | Dependência direcional da estrutura atômica | Forte e condutivo no plano, fraco perpendicular a ele |
Precisa de um Material que Suporte Calor Extremo?
As propriedades únicas do grafite o tornam uma escolha ideal para fornos de alta temperatura, cadinhos e outros equipamentos de laboratório exigentes. Na KINTEK, somos especializados no fornecimento de equipamentos e consumíveis de laboratório de alta qualidade, incluindo soluções à base de grafite, para atender às suas necessidades específicas de laboratório.
Entre em contato com nossos especialistas hoje mesmo para encontrar a solução perfeita de alta temperatura para sua aplicação!
Guia Visual
Produtos relacionados
- Forno de Grafitação a Vácuo de Ultra-Alta Temperatura de Grafite
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Forno de Grafitação Contínua a Vácuo de Grafite
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Como remover o gelo dos congeladores de temperatura ultrabaixa? Proteja suas amostras e equipamentos
- Qual é o processo de reação de sinterização? Transforme Pó em Peças Densas e de Alto Desempenho
- Um joalheiro consegue saber se um diamante foi aprimorado? Saiba a verdade sobre os tratamentos de diamantes
- Quais são as duas estruturas dos bolores? Compreendendo Hifas e Micélio
- Qual é o efeito do catalisador na pirólise? Controle as Vias de Reação para Produtos de Maior Valor
- A capacidade térmica afeta o ponto de fusão? Desvendando as Principais Diferenças nas Propriedades Térmicas
- Por que um forno elétrico a arco é melhor do que um alto-forno? Um guia para a produção moderna e sustentável de aço
- Qual é o desenvolvimento de filmes finos? De Experimentos do Século XVII à Engenharia em Escala Atômica



















