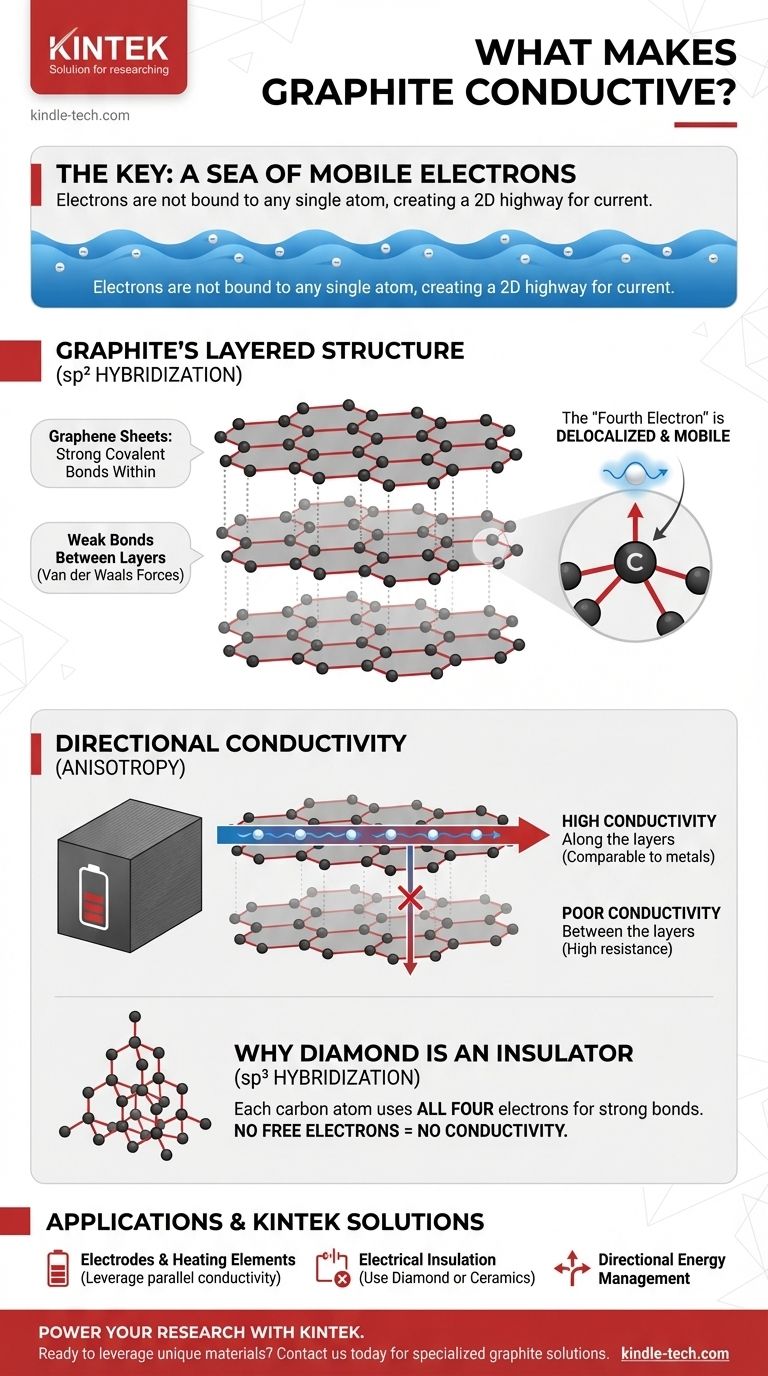
Em sua essência, a condutividade elétrica no grafite é causada por um mar de elétrons móveis que não estão ligados a nenhum átomo individual. Esse comportamento eletrônico único é um resultado direto da estrutura atômica em camadas específica do grafite e da maneira como seus átomos de carbono se ligam.
A percepção crucial é que, enquanto a maioria dos não-metais mantém seus elétrons presos no lugar, a estrutura única em forma de folha do grafite deixa um elétron por átomo livre para se mover. Este elétron "deslocalizado" cria uma "autoestrada" eletrônica 2D, permitindo que o grafite conduza eletricidade de forma muito semelhante a um metal.

A Base: A Estrutura em Camadas do Grafite
Para entender o fluxo de eletricidade, devemos primeiro visualizar a forma física do material. O grafite não é uma mistura aleatória de átomos; é um cristal altamente organizado.
Uma Pilha de Folhas de Grafeno
O grafite é composto por inúmeras camadas de átomos de carbono. Cada camada individual, conhecida como folha de grafeno, é um plano bidimensional e plano.
Ligações Fortes Internas, Ligações Fracas Entre as Camadas
Dentro de cada folha, os átomos de carbono são organizados em um padrão hexagonal de colmeia, conectados por ligações covalentes extremamente fortes. No entanto, as ligações que mantêm as folhas separadas unidas são muito fracas (forças de van der Waals).
O Papel do Elétron: Desbloqueando a Condutividade
A natureza específica das ligações dentro das folhas de grafeno é a verdadeira fonte da condutividade do grafite.
A Ligação de Hibridização sp²
Cada átomo de carbono possui quatro elétrons na camada externa disponíveis para ligação. No grafite, cada átomo usa três desses elétrons para formar ligações fortes e planas com seus três vizinhos na folha hexagonal.
O "Quarto Elétron" Cria um Mar de Mobilidade
Isso deixa um elétron por átomo de carbono que não está envolvido na estrutura de ligação primária. Este elétron ocupa um tipo diferente de orbital (orbital p) e não está mais ligado ao seu átomo original.
Em vez disso, esses "quartos elétrons" de todos os átomos em uma folha se unem para formar um mar deslocalizado de elétrons. Esses elétrons são livres para se mover para qualquer lugar em toda a superfície bidimensional de sua folha de grafeno.
Como os Elétrons Móveis Permitem a Corrente
Corrente elétrica é simplesmente o fluxo de carga. Quando uma voltagem é aplicada a um pedaço de grafite, essa vasta piscina de elétrons móveis é facilmente empurrada ao longo das folhas de grafeno, criando uma poderosa corrente elétrica.
Compreendendo as Compensações: Condutividade Direcional
A condutividade do grafite não é uniforme em todas as direções. Essa propriedade, conhecida como anisotropia, é uma consideração crítica em qualquer aplicação prática.
Alta Condutividade Ao Longo das Camadas
A eletricidade flui excepcionalmente bem paralelamente às folhas de grafeno. O mar de elétrons deslocalizados fornece um caminho quase desobstruído para a corrente, tornando a condutividade do grafite nessa direção comparável a muitos metais.
Baixa Condutividade Entre as Camadas
Em contraste, é muito difícil para os elétrons saltarem de uma folha para a próxima. A grande lacuna e as forças fracas entre as camadas criam alta resistência, tornando o grafite um mau condutor perpendicular às suas camadas.
Por Que o Diamante Não é Condutor? Uma Comparação Chave
Para apreciar plenamente a singularidade do grafite, ajuda compará-lo ao diamante, outra forma de carbono puro.
A Ligação sp³ no Diamante
No diamante, cada átomo de carbono usa todos os quatro de seus elétrons externos para formar fortes ligações covalentes com quatro átomos vizinhos em uma rede rígida e tridimensional.
Sem Elétrons Livres, Sem Condutividade
Como cada elétron está preso em uma ligação fixa e localizada, não há elétrons móveis disponíveis para transportar uma corrente. É por isso que o diamante é um dos isolantes elétricos mais conhecidos.
Como Aplicar Isso ao Seu Objetivo
As propriedades únicas da condutividade do grafite ditam seu uso em várias aplicações.
- Se o seu foco principal é criar um eletrodo ou elemento de aquecimento: Aproveite a excelente condutividade do grafite ao longo de seus planos, orientando o material para que a corrente flua paralelamente às folhas de grafeno.
- Se o seu foco principal é o isolamento elétrico: O grafite é a escolha errada; um material como diamante ou uma cerâmica é necessário, pois eles não possuem elétrons livres.
- Se o seu foco principal é gerenciar o calor ou a eletricidade direcionalmente: A natureza anisotrópica do grafite é uma vantagem, permitindo canalizar energia ao longo de um eixo enquanto isola ao longo de outro.
Em última análise, o grafite serve como um exemplo perfeito de como a estrutura atômica de um material dita diretamente suas propriedades mais fundamentais.
Tabela Resumo:
| Fator Chave | Papel na Condutividade |
|---|---|
| Hibridização sp² | Cria uma rede hexagonal 2D, deixando um elétron por átomo deslocalizado. |
| Elétrons Deslocalizados | Forma um "mar" de portadores de carga móveis que podem se mover livremente dentro de uma folha de grafeno. |
| Estrutura em Camadas | Permite alta condutividade ao longo das folhas, mas baixa condutividade entre elas (anisotropia). |
| Comparação com Diamante (sp³) | O diamante não possui elétrons livres (todos os elétrons estão ligados), tornando-o um isolante. |
Pronto para aproveitar as propriedades condutivas únicas do grafite em seu laboratório?
Na KINTEK, somos especializados em equipamentos e consumíveis de laboratório de alta qualidade. Se você precisa de grafite para eletrodos, elementos de aquecimento ou aplicações especializadas, nossos materiais são projetados para fornecer desempenho superior e condutividade direcional.
Entre em contato conosco hoje para discutir como nossas soluções podem impulsionar sua pesquisa e inovação. Deixe nossos especialistas ajudá-lo a selecionar os materiais perfeitos para suas necessidades específicas de laboratório.
Entre em contato com nossa equipe agora →
Guia Visual
Produtos relacionados
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Forno de Grafitação Contínua a Vácuo de Grafite
- Forno de Grafitação a Vácuo de Ultra-Alta Temperatura de Grafite
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é a resistência à temperatura do grafite? Desvendando o seu potencial de alta temperatura no seu laboratório
- O grafite suporta altas temperaturas? Maximizando o Desempenho em Atmosferas Controladas
- Quais são os usos industriais do grafite? Aproveite as suas propriedades únicas para aplicações exigentes
- Quais são as aplicações industriais do grafite? Da Metalurgia aos Semicondutores
- O grafite é bom para altas temperaturas? Desvende Todo o Seu Potencial em Atmosferas Controladas



















