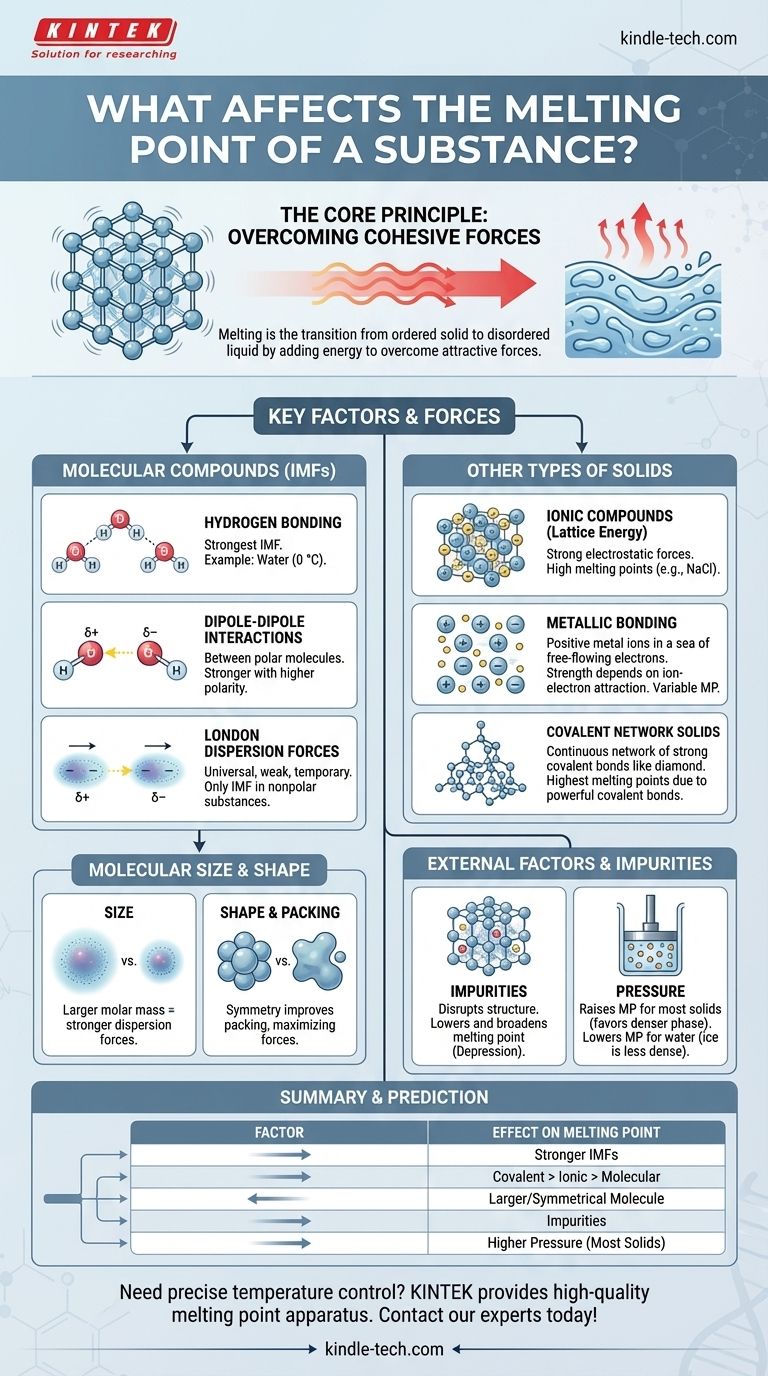
Em sua essência, o ponto de fusão de uma substância é determinado pela energia necessária para superar as forças atrativas que mantêm suas partículas em uma estrutura tridimensional fixa. Os fatores primários são a força dessas forças — sejam ligações químicas ou forças intermoleculares mais fracas — e a forma como as partículas se empacotam. Fatores como tamanho molecular, forma e a presença de impurezas também desempenham um papel crucial.
O princípio central é simples: forças atrativas mais fortes entre as partículas exigem mais energia térmica para serem quebradas, resultando em um ponto de fusão mais alto. Toda a história dos pontos de fusão é uma exploração do que cria e modifica essas forças.

O Princípio Central: Superando as Forças Coesivas
A fusão é uma transformação física de um estado sólido ordenado para um estado líquido desordenado. Compreender essa transição é fundamental para entender os fatores que a controlam.
O que é Fusão?
Em um sólido, átomos, íons ou moléculas estão presos em um arranjo fixo chamado rede cristalina. Eles vibram no lugar, mas não se movem uns pelos outros.
A fusão ocorre na temperatura específica em que essas partículas ganham energia cinética suficiente do calor para se libertarem de suas posições fixas e começarem a fluir.
Energia vs. Coesão
O calor que você adiciona a uma substância aumenta a energia cinética de suas partículas, fazendo com que vibrem mais intensamente. O ponto de fusão é a temperatura de equilíbrio onde essa energia vibracional se torna poderosa o suficiente para superar as forças coesivas que mantêm a rede unida.
Fatores Chave para Compostos Moleculares
Para substâncias feitas de moléculas discretas (como água, cera ou açúcar), as forças entre as moléculas — e não as ligações dentro delas — são o que se quebra durante a fusão. Estas são chamadas de forças intermoleculares (FIMs).
Ligação de Hidrogênio: A FIM Mais Forte
Uma ligação de hidrogênio é um tipo poderoso de interação dipolo-dipolo que ocorre quando o hidrogênio está ligado a um átomo altamente eletronegativo como nitrogênio (N), oxigênio (O) ou flúor (F).
A água (H₂O) é um exemplo clássico. Seu alto ponto de fusão (0 °C) em comparação com moléculas de tamanho semelhante é inteiramente devido à forte rede de ligações de hidrogênio que mantêm as moléculas unidas no gelo.
Interações Dipolo-Dipolo
Essas forças existem entre moléculas polares, que possuem extremidades parciais positivas e parciais negativas permanentes. A extremidade positiva de uma molécula atrai a extremidade negativa de sua vizinha.
Quanto maior a polaridade da molécula, mais forte a atração dipolo-dipolo e mais alto o ponto de fusão.
Forças de Dispersão de London: A Força Universal
Essas atrações temporárias e fracas existem em todas as moléculas, tanto polares quanto apolares. Elas surgem de flutuações momentâneas na nuvem eletrônica ao redor de uma molécula, criando dipolos efêmeros.
Para substâncias apolares como metano (CH₄) ou octano (C₈H₁₈), as forças de dispersão de London são as únicas FIMs presentes.
O Papel do Tamanho e Forma Molecular
Tamanho (Massa Molar): Moléculas maiores têm nuvens eletrônicas maiores, que são mais facilmente distorcidas. Isso leva a forças de dispersão de London mais fortes e, consequentemente, a pontos de fusão mais altos. É por isso que hidrocarbonetos grandes e cerosos são sólidos à temperatura ambiente, enquanto os pequenos, como o metano, são gases.
Simetria e Empacotamento: Moléculas simétricas e compactas podem se empacotar de forma mais justa e eficiente em uma rede cristalina. Esse empacotamento compacto maximiza a eficácia das forças intermoleculares, levando a um ponto de fusão mais alto do que para isômeros de forma irregular do mesmo tamanho.
Além das Moléculas: Outros Tipos de Sólidos
Nem todos os sólidos são feitos de moléculas discretas. Em muitos materiais, a fusão requer a quebra de poderosas ligações químicas que se estendem por toda a estrutura.
Compostos Iônicos e Energia de Rede
Em compostos iônicos como o sal de cozinha (NaCl), íons positivos e negativos são mantidos em uma rede rígida por fortes forças eletrostáticas (ligações iônicas). A fusão dessas substâncias requer a superação dessa imensa atração, que é medida pela energia de rede.
Como as ligações iônicas são muito mais fortes do que as forças intermoleculares, os compostos iônicos têm pontos de fusão muito altos.
Metais e Ligação Metálica
Os metais são mantidos unidos por ligações metálicas, onde um "mar" de elétrons deslocalizados flui livremente entre uma rede fixa de íons metálicos positivos.
A força da atração entre os íons e esse mar de elétrons determina o ponto de fusão. Metais como tungstênio e titânio formam ligações metálicas muito fortes e têm pontos de fusão excepcionalmente altos.
Sólidos de Rede Covalente
Nesses materiais, os átomos são unidos por uma rede contínua de fortes ligações covalentes. Não há moléculas individuais.
Para fundir um sólido de rede covalente como o diamante (carbono) ou o quartzo (dióxido de silício), é preciso quebrar essas poderosas ligações covalentes. Isso requer uma quantidade tremenda de energia, dando-lhes os pontos de fusão mais altos de qualquer classe de substância.
Compreendendo as Trocas e Fatores Externos
As propriedades intrínsecas de uma substância não são a única influência. As condições externas e a composição também têm um impacto significativo.
O Efeito das Impurezas: Depressão do Ponto de Fusão
A presença de uma impureza perturba a estrutura uniforme de uma rede cristalina. Essa rede enfraquecida e desorganizada requer menos energia para se desintegrar.
Esse fenômeno é conhecido como depressão do ponto de fusão. É por isso que uma substância pura tem um ponto de fusão nítido e distinto, enquanto uma substância impura derrete em uma faixa de temperatura mais ampla e mais baixa. É também o princípio por trás do uso de sal para derreter o gelo nas estradas no inverno.
A Influência da Pressão
Para a maioria das substâncias, a fase sólida é mais densa que a fase líquida. O aumento da pressão favorece o estado mais denso, empurrando as partículas para mais perto e tornando mais difícil para elas se libertarem. Portanto, para a maioria dos materiais, pressões mais altas elevam o ponto de fusão.
A água é uma exceção famosa. Como o gelo é menos denso que a água líquida, o aumento da pressão favorece o estado líquido, diminuindo assim o ponto de fusão.
Como Prever Pontos de Fusão Relativos
Use esses princípios para comparar diferentes substâncias e prever seu comportamento.
- Se você estiver comparando um composto de rede covalente, iônico e molecular: O de rede covalente (por exemplo, diamante) será o mais alto, seguido pelo iônico (por exemplo, sal), sendo o composto molecular (por exemplo, açúcar) muito mais baixo.
- Se você estiver comparando compostos moleculares: Primeiro, verifique a ligação de hidrogênio, que é um fator dominante. Se ausente, compare a polaridade. Se todos forem apolares ou tiverem polaridade semelhante, aquele com a maior massa molar geralmente terá o ponto de fusão mais alto.
- Se você estiver comparando compostos iônicos: O composto com as maiores cargas em seus íons e/ou menores raios iônicos terá uma energia de rede mais forte e um ponto de fusão mais alto.
- Se você precisar avaliar a pureza: Uma substância que derrete nitidamente em seu ponto de fusão conhecido é provavelmente pura, enquanto uma que derrete gradualmente em uma faixa abaixo do seu ponto esperado é impura.
Ao compreender essas forças fundamentais, você pode prever efetivamente como a estrutura microscópica de uma substância dita seu comportamento de fusão.
Tabela Resumo:
| Fator | Efeito no Ponto de Fusão | Princípio Chave |
|---|---|---|
| Forças Intermoleculares (FIMs) | Mais alto com FIMs mais fortes | Ligação de hidrogênio > dipolo-dipolo > dispersão de London |
| Tipo de Ligação Química | Rede covalente > Iônica > Metálica > Molecular | Força das ligações que devem ser quebradas |
| Tamanho/Forma Molecular | Mais alto com maior massa molar e forma simétrica | Aumenta as forças de London e melhora o empacotamento da rede |
| Impurezas | Diminui (Depressão do Ponto de Fusão) | Perturba a rede cristalina, exigindo menos energia para fundir |
| Pressão | Aumenta (para a maioria dos sólidos); Diminui (para gelo/água) | Favorece a fase mais densa (sólida para a maioria, líquida para a água) |
Precisa de controle preciso de temperatura para sua análise de materiais? Compreender os pontos de fusão é fundamental para a caracterização de materiais, avaliação de pureza e desenvolvimento de processos. A KINTEK é especializada no fornecimento de equipamentos de laboratório de alta qualidade, incluindo aparelhos de ponto de fusão e fornos, para ajudar seu laboratório a obter resultados precisos e confiáveis. Entre em contato com nossos especialistas hoje para encontrar a solução perfeita para sua aplicação específica!
Guia Visual
Produtos relacionados
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de 1800℃ para Laboratório
- Forno Muffle de 1400℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Quais são os métodos de determinação de cinzas? Escolhendo a Técnica Certa para Análise Mineral Precisa
- Para que serve um forno mufla? Medir cinzas, matéria volátil e umidade com precisão
- Quanto tempo dura o processo de calcinação? Otimize o tempo do seu processo para máxima eficiência
- Quais são os fatores que afetam a taxa do processo de fusão? Domine a Transferência de Calor para Resultados Mais Rápidos
- Como manter um forno mufla? Garanta Confiabilidade e Segurança a Longo Prazo



















