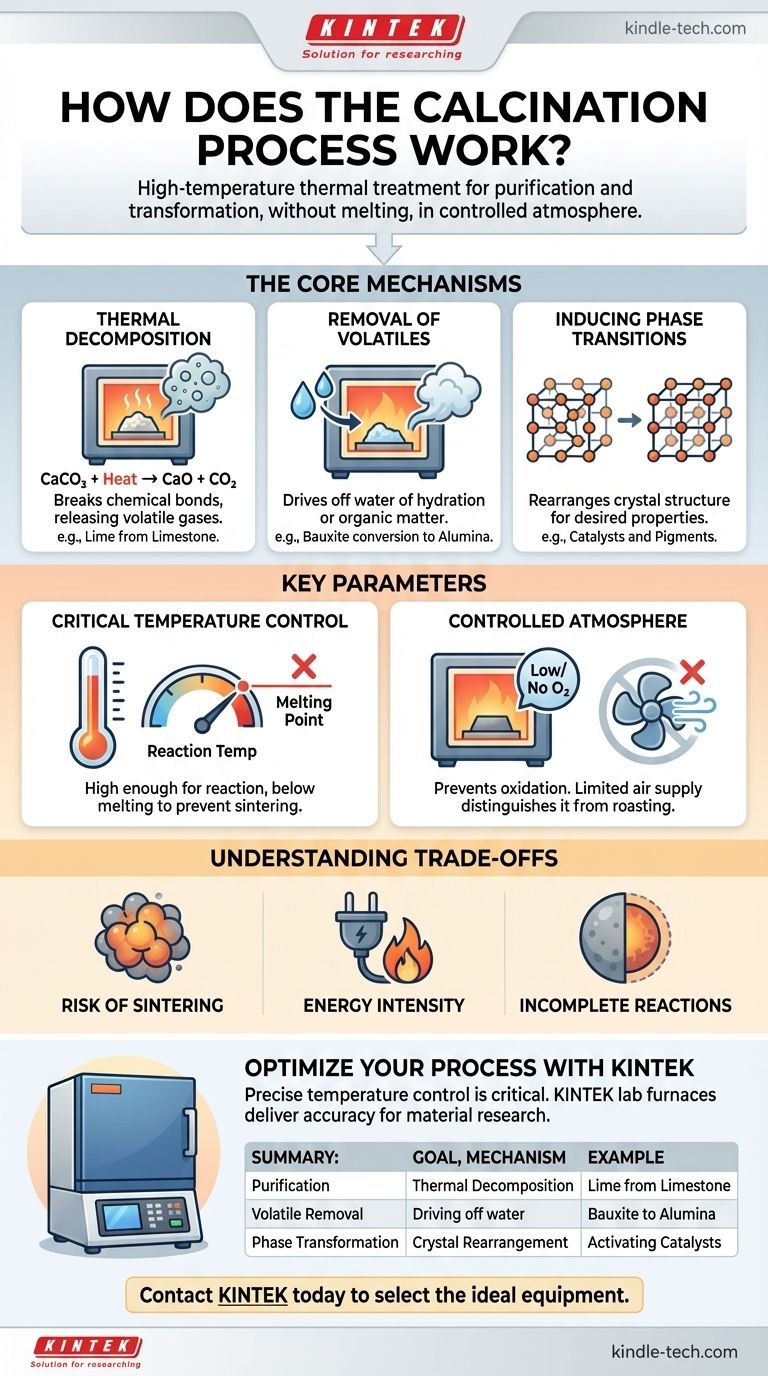
Em essência, a calcinação é um processo de purificação e transformação impulsionado pelo calor. É um tipo específico de tratamento térmico aplicado a materiais sólidos, onde são aquecidos a uma alta temperatura, mas abaixo do seu ponto de fusão. Isso é realizado na ausência ou com um suprimento muito limitado de ar, o que é um detalhe crítico que o distingue de outros processos térmicos. Os objetivos primários são induzir a decomposição térmica, eliminar substâncias voláteis como água ou dióxido de carbono, ou desencadear uma mudança na estrutura cristalina do material.
A calcinação não é simplesmente aquecer um material; é um processo térmico preciso projetado para alterar a composição química ou a estrutura física de um material sem fundi-lo. A chave é controlar a temperatura e a atmosfera para alcançar um resultado específico, como decomposição ou purificação.

Os Mecanismos Centrais da Calcinação
A calcinação alcança seus resultados através de várias mudanças físicas e químicas distintas. O objetivo específico do processo determina qual desses mecanismos é o mais importante.
Decomposição Térmica
Este é o objetivo mais comum da calcinação. O processo aplica energia térmica suficiente para quebrar ligações químicas dentro de um composto, decompondo-o em substâncias mais simples.
Um exemplo industrial clássico é a produção de cal (óxido de cálcio) a partir de calcário (carbonato de cálcio). Quando aquecido, o carbonato se decompõe, liberando gás dióxido de carbono.
CaCO₃ (sólido) + Calor → CaO (sólido) + CO₂ (gás)
Este óxido de cálcio resultante é um componente fundamental na fabricação de cimento e aço.
Remoção de Voláteis
Muitos minerais brutos contêm água, seja fisicamente absorvida ou quimicamente ligada à sua estrutura cristalina (conhecida como água de hidratação). A calcinação fornece a energia para remover essa água na forma de vapor.
Por exemplo, a conversão de bauxita em alumina para a produção de alumínio envolve calcinação para remover sua água de hidratação. Da mesma forma, este processo é usado para remover matéria orgânica volátil de vários materiais.
Indução de Transições de Fase
Às vezes, o objetivo não é mudar a composição química, mas alterar as propriedades físicas do material. Aquecer um material pode fazer com que seus átomos se rearranjem em uma estrutura cristalina diferente, muitas vezes mais estável ou funcionalmente útil.
Isso é comum na produção de catalisadores e pigmentos cerâmicos, onde uma fase cristalina específica possui a atividade catalítica ou a cor desejada.
Parâmetros Chave que Definem o Processo
Calcinar um material com sucesso requer controle preciso sobre várias variáveis. Esses parâmetros ditam a eficiência e o resultado de todo o processo.
O Papel Crítico da Temperatura
A temperatura de calcinação deve ser cuidadosamente controlada. Ela precisa ser alta o suficiente para fornecer a energia de ativação para a reação desejada (por exemplo, decomposição), mas deve permanecer estritamente abaixo do ponto de fusão do material.
Se a temperatura for muito baixa, a reação será incompleta. Se for muito alta, o material pode derreter ou sinterizar (fundir), o que é tipicamente um resultado indesejável.
A Atmosfera Controlada
A calcinação é definida por seu ambiente com baixo teor de oxigênio ou sem oxigênio. Isso é crucial para prevenir a oxidação, que é uma reação química completamente diferente.
Processos que aquecem materiais na presença de ar abundante para causar deliberadamente a oxidação são conhecidos como torrefação, não calcinação. Essa distinção é fundamental na metalurgia e na ciência dos materiais.
Compreendendo as Vantagens e Limitações
Embora poderosa, a calcinação não está isenta de desafios. Compreender suas limitações é fundamental para aplicá-la de forma eficaz.
Risco de Sinterização
O controle inadequado da temperatura é o risco principal. Se a temperatura se aproximar muito do ponto de fusão do material, partículas individuais podem começar a se fundir. Esse processo de sinterização reduz a área de superfície e pode arruinar as propriedades desejadas do produto final.
Intensidade Energética
Manter as altas temperaturas necessárias para a calcinação (muitas vezes 800-1000°C ou mais) exige uma quantidade significativa de energia. Isso o torna um processo custoso com uma pegada ambiental notável, especialmente para reações como a produção de cal que liberam grandes volumes de CO₂.
Reações Incompletas
Alcançar uma reação 100% completa pode ser difícil. Se o material não for aquecido por tempo suficiente, ou se a transferência de calor for deficiente devido a grandes tamanhos de partículas, parte do material original não decomposto pode permanecer, comprometendo a pureza do produto final.
Fazendo a Escolha Certa para o Seu Objetivo
Os parâmetros específicos do seu processo de calcinação dependem inteiramente do seu produto final desejado.
- Se o seu foco principal é produzir um óxido a partir de um carbonato: Você deve garantir que a temperatura seja alta o suficiente para eliminar todo o CO₂, mas baixa o suficiente para evitar a sinterização do produto óxido final.
- Se o seu foco principal é remover umidade: Um perfil de temperatura mais baixo pode ser suficiente, focando na remoção da água sem desencadear decomposição química indesejada.
- Se o seu foco principal é alcançar uma fase cristalina específica: O controle preciso da temperatura e do tempo de permanência são primordiais, pois as transições de fase ocorrem dentro de janelas de temperatura específicas.
Em última análise, dominar a calcinação reside em compreendê-la como uma ferramenta para projetar precisamente as propriedades finais de um material através de energia térmica controlada.
Tabela Resumo:
| Objetivo da Calcinação | Mecanismo Chave | Exemplo de Aplicação |
|---|---|---|
| Purificação / Decomposição | Decomposição térmica de compostos (por exemplo, carbonatos). | Produção de cal (CaO) a partir de calcário (CaCO₃). |
| Remoção de Voláteis | Eliminação de água (hidratação) ou outras substâncias voláteis. | Conversão de bauxita em alumina para produção de alumínio. |
| Transformação de Fase | Reorganização da estrutura cristalina para alterar as propriedades do material. | Ativação de catalisadores ou desenvolvimento de pigmentos cerâmicos. |
Pronto para Otimizar Seu Processo de Calcinação?
O controle preciso da temperatura é crítico para o sucesso da calcinação. A KINTEK é especializada em fornos de laboratório de alto desempenho que oferecem a precisão e a confiabilidade que seu laboratório precisa para pesquisa de purificação de materiais, decomposição e transformação de fase.
Entre em contato com a KINTEK hoje para discutir sua aplicação específica. Nossos especialistas o ajudarão a selecionar o equipamento ideal para alcançar seus objetivos na ciência dos materiais.
Guia Visual
Produtos relacionados
- Forno Muffle de 1400℃ para Laboratório
- Forno de Mufla de 1800℃ para Laboratório
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de 1700℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Quais são os diferentes tipos de fornos de laboratório? Encontre o ajuste perfeito para sua aplicação
- Qual é a diferença entre um forno mufla e um forno normal? Garantindo a Pureza da Amostra com Aquecimento Indireto
- Como preparar amostras para IV? Um Guia para Preparação de Amostras Sólidas, Líquidas e Gasosas
- É necessário aquecer o cadinho limpo antes de usá-lo? Previna o Choque Térmico e Garanta a Precisão do Processo
- Como as propriedades dos materiais mudam com o tratamento térmico? Adapte Dureza, Resistência e Ductilidade



















