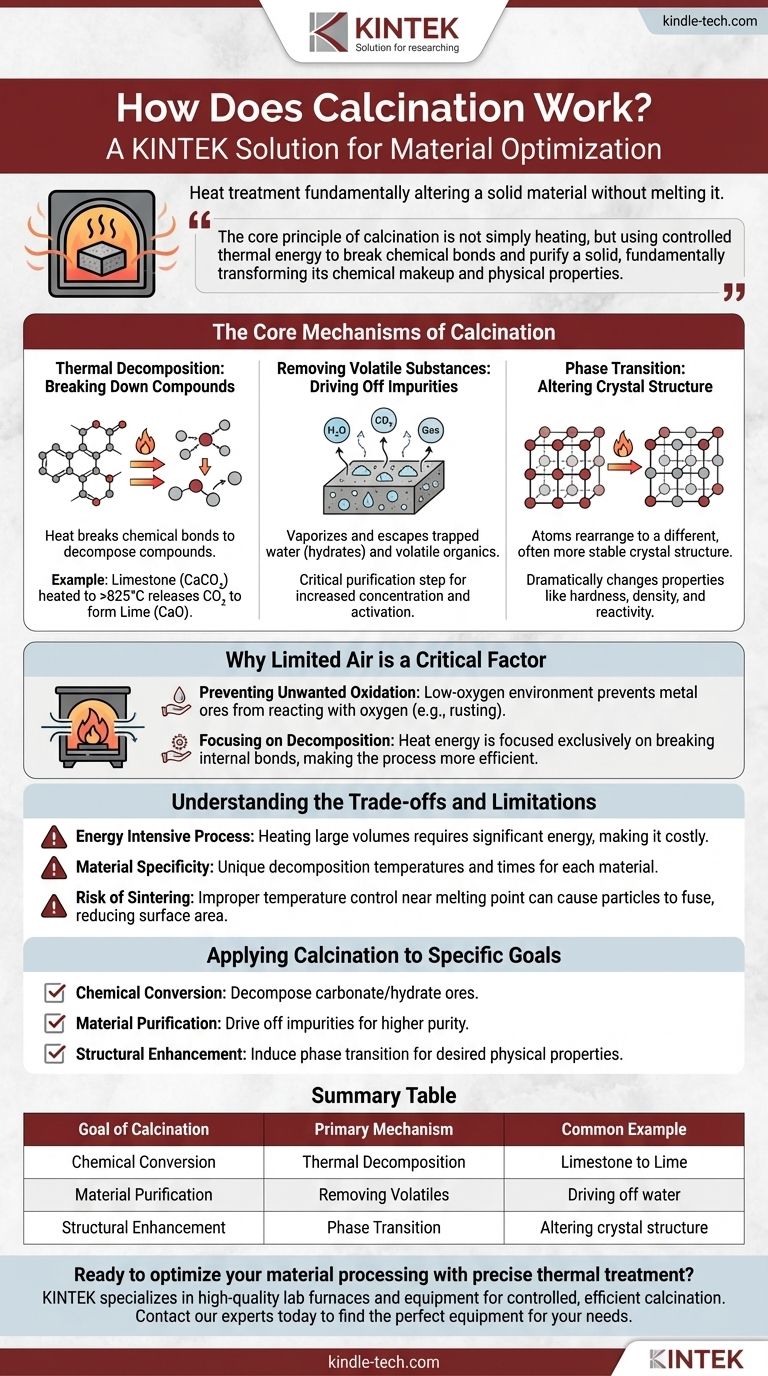
Em essência, a calcinação é um processo de tratamento térmico que altera fundamentalmente um material sólido sem derretê-lo. Ao aquecer uma substância a uma alta temperatura em um ambiente de baixo oxigênio, ela força a decomposição térmica, elimina impurezas voláteis como água e dióxido de carbono, ou altera a estrutura cristalina interna do material.
O princípio central da calcinação não é simplesmente aquecer, mas usar energia térmica controlada para quebrar ligações químicas e purificar um sólido, transformando fundamentalmente sua composição química e propriedades físicas.

Os Mecanismos Centrais da Calcinação
Para entender como a calcinação funciona, você deve observar as três principais mudanças que ela pode induzir em um material quando submetido a altas temperaturas.
Decomposição Térmica: Quebrando Compostos
Este é o objetivo mais comum da calcinação. O calor fornece a energia necessária para quebrar as ligações químicas dentro de um composto, fazendo com que ele se decomponha em substâncias mais simples.
O exemplo clássico é a produção de cal (óxido de cálcio) a partir de calcário (carbonato de cálcio). Quando aquecido a mais de 825°C (1517°F), o calcário se decompõe, liberando dióxido de carbono gasoso e deixando para trás a cal purificada.
Remoção de Substâncias Voláteis: Eliminando Impurezas
Muitas matérias-primas contêm água aprisionada (hidratos) ou outros compostos orgânicos voláteis. A calcinação aquece o material a um ponto em que essas substâncias vaporizam e escapam.
Este é um passo crítico de purificação, deixando uma versão mais concentrada ou anidra (sem água) do material desejado. Isso aumenta a pureza e pode "ativar" o material para processos subsequentes.
Transição de Fase: Alterando a Estrutura Cristalina
Às vezes, o objetivo não é mudar a composição química, mas alterar a forma física do material.
O aquecimento pode fazer com que os átomos em um sólido se rearranjem em uma estrutura cristalina diferente, muitas vezes mais estável ou útil. Isso é conhecido como transição de fase, e pode mudar drasticamente propriedades como dureza, densidade e reatividade.
Por Que o Ar Limitado é um Fator Crítico
A condição de usar um suprimento limitado de ar (ou nenhum ar) é o que distingue a calcinação de outros tratamentos térmicos como a torrefação.
Prevenindo Oxidação Indesejada
Muitos minérios metálicos, quando aquecidos na presença de oxigênio, reagem com ele para formar um óxido. Este é o mesmo processo básico da ferrugem.
Ao realizar o aquecimento em um ambiente de baixo oxigênio, a calcinação previne especificamente que essas reações de oxidação indesejadas ocorram, garantindo que a mudança química desejada aconteça.
Focando na Decomposição
Com o oxigênio removido da equação, a energia térmica aplicada é focada exclusivamente em uma tarefa: quebrar as ligações internas do próprio material. Isso torna o processo mais eficiente e previsível para seu propósito pretendido.
Compreendendo as Trocas e Limitações
Embora poderosa, a calcinação é um processo industrial preciso com considerações importantes.
Processo Intensivo em Energia
Aquecer grandes volumes de materiais sólidos a centenas ou mesmo milhares de graus requer uma quantidade significativa de energia. Isso o torna um passo caro e intensivo em recursos em qualquer cadeia de produção.
Especificidade do Material
Não existe uma temperatura universal para a calcinação. Cada material tem uma temperatura de decomposição e tempo de aquecimento necessários únicos. O que funciona perfeitamente para o calcário pode ser completamente ineficaz ou até destrutivo para outro tipo de minério.
Risco de Sinterização
Se a temperatura for controlada inadequadamente e se aproximar demais do ponto de fusão do material, as partículas podem começar a se fundir. Este processo, chamado de sinterização, pode reduzir a área de superfície e a reatividade do produto final, o que muitas vezes é indesejável.
Aplicando a Calcinação a Objetivos Específicos
A decisão de usar a calcinação depende inteiramente do resultado desejado.
- Se o seu foco principal é a conversão química: A calcinação é o método ideal para decompor um carbonato ou minério hidratado em uma forma de óxido mais útil.
- Se o seu foco principal é a purificação do material: Use a calcinação para eliminar impurezas voláteis como água ou solventes residuais, criando um produto final mais concentrado e puro.
- Se o seu foco principal é o aprimoramento estrutural: Aplique a calcinação para induzir uma transição de fase, alterando a estrutura cristalina do material para alcançar as propriedades físicas desejadas.
Em última análise, a calcinação é uma ferramenta fundamental para projetar precisamente a composição química e as propriedades físicas de materiais sólidos.
Tabela Resumo:
| Objetivo da Calcinação | Mecanismo Primário | Exemplo Comum |
|---|---|---|
| Conversão Química | Decomposição Térmica | Calcário (CaCO₃) para Cal (CaO) |
| Purificação do Material | Remoção de Voláteis | Eliminação de água de um hidrato |
| Aprimoramento Estrutural | Transição de Fase | Alteração da estrutura cristalina de um material |
Pronto para otimizar o processamento de seus materiais com tratamento térmico preciso? O processo de calcinação é crítico para alcançar as propriedades químicas e físicas corretas em seus materiais. A KINTEK é especializada em fornos de laboratório e equipamentos de alta qualidade projetados para calcinação controlada e eficiente. Seja em pesquisa, desenvolvimento ou produção, nossas soluções ajudam você a eliminar impurezas, induzir transições de fase e alcançar resultados superiores. Entre em contato com nossos especialistas hoje para encontrar o equipamento de calcinação perfeito para as necessidades específicas do seu laboratório.
Guia Visual
Produtos relacionados
- Forno de Mufla de 1800℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno Muffle de 1400℃ para Laboratório
- Forno de Mufla de Alta Temperatura para Desgaseificação e Pré-Sinterização de Laboratório
As pessoas também perguntam
- Qual é a diferença entre um forno mufla e um forno normal? Garantindo a Pureza da Amostra com Aquecimento Indireto
- Como você controla um forno mufla? Domine o Controle Preciso de Temperatura para o Seu Laboratório
- O que é feito pela incineração em forno mufla? Um guia para análise precisa de conteúdo inorgânico
- Quais são as condições para um forno mufla? Garanta Segurança, Desempenho e Longevidade
- É necessário aquecer o cadinho limpo antes de usá-lo? Previna o Choque Térmico e Garanta a Precisão do Processo



















