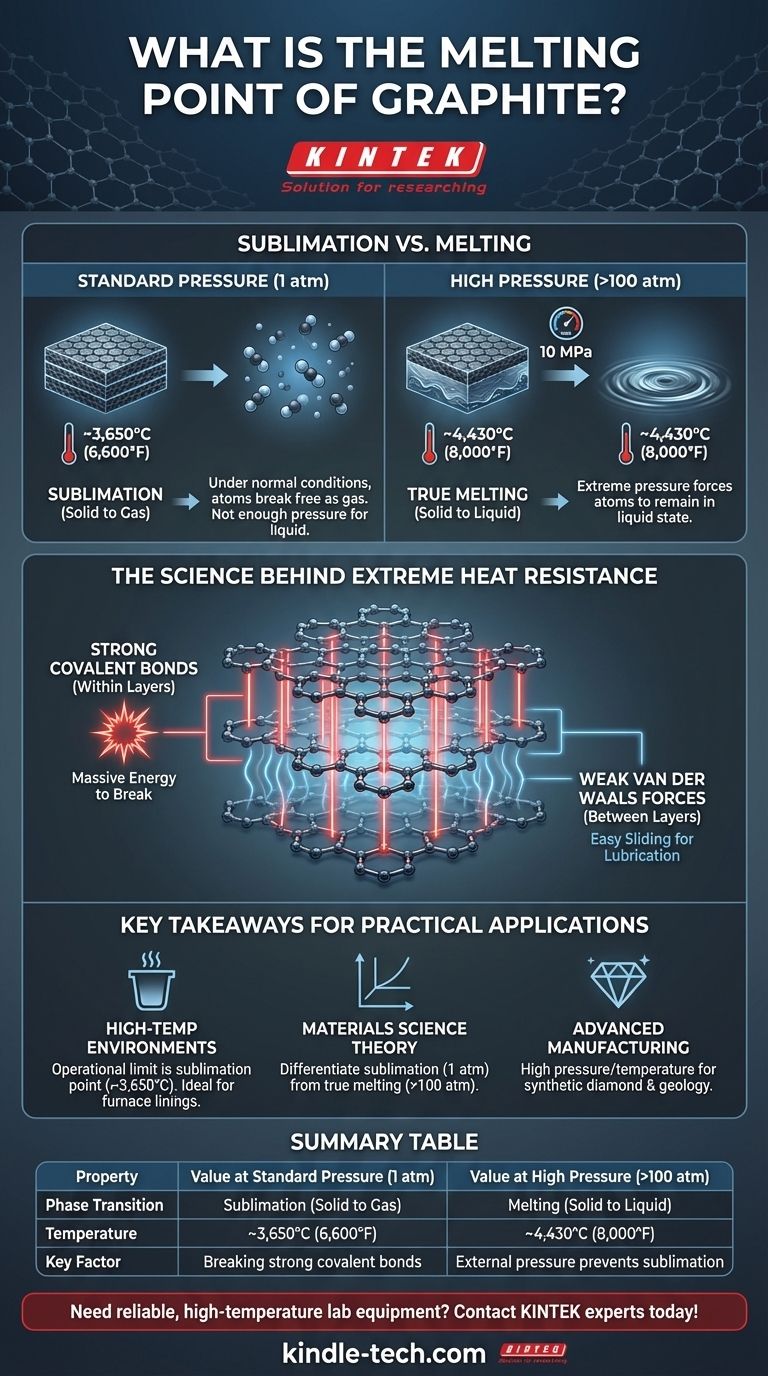
Em condições normais, o grafite não derrete. Em vez de se transformar em líquido, ele sublima — passando diretamente de sólido para gás — a aproximadamente 3.650°C (6.600°F). A fusão verdadeira só ocorre sob pressão extrema, que força os átomos de carbono a permanecerem em estado líquido a uma temperatura muito mais alta.
A imensa estabilidade térmica do grafite não é um acidente de sua composição, mas uma consequência direta de sua estrutura atômica. As ligações covalentes excepcionalmente fortes que mantêm os átomos de carbono unidos em camadas exigem uma enorme quantidade de energia para serem quebradas, resultando em um dos pontos de sublimação mais altos de qualquer elemento.

A Ciência por Trás da Resistência Extrema ao Calor do Grafite
Para entender por que o grafite é tão resistente ao calor, devemos observar como seus átomos de carbono estão dispostos e ligados.
O Poder das Ligações Covalentes
O grafite é um alótropo do carbono, o que significa que é uma das várias formas físicas que o elemento pode assumir. Sua estrutura consiste em planos planos e bidimensionais de átomos de carbono dispostos em uma rede hexagonal.
Dentro de cada um desses planos (uma única camada é conhecida como grafeno), cada átomo de carbono está ligado a três outros por ligações covalentes extremamente fortes. São essas ligações que conferem ao grafite sua incrível estabilidade térmica. Quebrá-las exige uma tremenda quantidade de energia, o que se traduz diretamente em uma temperatura muito alta.
Camadas vs. Ligações: Uma Distinção Fundamental
Um ponto comum de confusão é o uso do grafite como lubrificante. Se é tão forte, por que também é escorregadio?
A resposta reside na diferença entre as forças dentro das camadas e as forças entre elas. Embora as ligações covalentes dentro de cada folha de grafeno sejam poderosas, as ligações que mantêm as folhas separadas são as muito fracas forças de van der Waals.
Essas fracas forças intercamadas permitem que os planos deslizem facilmente uns sobre os outros, criando o efeito lubrificante do grafite. No entanto, derreter ou sublimar o material exige quebrar as fortes ligações covalentes dentro das camadas, e não as fracas entre elas.
Fusão vs. Sublimação: Uma Distinção Crítica
Os termos "ponto de fusão" e "ponto de sublimação" são frequentemente usados de forma intercambiável para o grafite, mas descrevem fenômenos físicos diferentes que ocorrem sob condições muito distintas.
Sublimação à Pressão Padrão
À pressão atmosférica padrão (1 atm), não há força suficiente para manter os átomos de carbono juntos em fase líquida à medida que ganham energia do calor.
Em vez de as ligações afrouxarem o suficiente para formar um líquido, os átomos ganham tanta energia que se libertam completamente da estrutura sólida e escapam como gás. Essa transição direta de sólido para gás é a sublimação.
Fusão Verdadeira sob Alta Pressão
Para forçar o grafite a derreter, você deve aplicar pressão imensa. O ponto triplo do carbono — a condição específica em que sólido, líquido e gás podem coexistir — ocorre a uma pressão de cerca de 10 megapascals (MPa), ou aproximadamente 100 vezes a pressão atmosférica normal.
Sob essas condições, a pressão externa impede que os átomos de carbono se separem em gás. Em vez disso, eles passam para um estado líquido a uma temperatura de aproximadamente 4.430°C (8.000°F). Este é o verdadeiro ponto de fusão do grafite.
Principais Conclusões para Aplicações Práticas
Sua compreensão do comportamento do grafite em altas temperaturas informa diretamente seu uso na ciência e na indústria.
- Se o seu foco principal são ambientes de alta temperatura (ex: cadinhos, revestimentos de fornos): Confie no ponto de sublimação do grafite como limite operacional, pois a fusão não é uma preocupação sob pressões normais.
- Se o seu foco principal é a teoria da ciência dos materiais: Diferencie claramente entre o ponto de sublimação (a 1 atm) e o ponto de fusão verdadeiro (a >100 atm) para descrever com precisão o diagrama de fase do carbono.
- Se o seu foco principal é fabricação avançada ou geologia: A alta pressão e temperatura necessárias para o carbono líquido são relevantes para a compreensão de processos como a formação de diamantes sintéticos e as condições no manto terrestre profundo.
Em última análise, a resiliência do grafite é um reflexo direto das poderosas ligações covalentes que formam o bloco de construção fundamental de sua estrutura.
Tabela de Resumo:
| Propriedade | Valor à Pressão Padrão (1 atm) | Valor sob Alta Pressão (>100 atm) |
|---|---|---|
| Transição de Fase | Sublimação (Sólido para Gás) | Fusão (Sólido para Líquido) |
| Temperatura | ~3.650°C (6.600°F) | ~4.430°C (8.000°F) |
| Fator Chave | Ruptura de fortes ligações covalentes nas folhas de grafeno | Pressão externa impede a sublimação |
Precisa de equipamentos laboratoriais confiáveis e de alta temperatura? A excepcional estabilidade térmica do grafite o torna ideal para revestimentos de fornos, cadinhos e aplicações de alto calor. Na KINTEK, especializamo-nos em equipamentos e consumíveis laboratoriais premium, fornecendo as ferramentas duráveis que o seu laboratório precisa para operar com segurança e eficiência em temperaturas extremas. Fale com nossos especialistas hoje mesmo para encontrar a solução perfeita para seus desafios de alta temperatura!
Guia Visual
Produtos relacionados
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Forno de Grafitação a Vácuo de Ultra-Alta Temperatura de Grafite
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno de Grafitação Contínua a Vácuo de Grafite
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Quais são as vantagens e desvantagens do grafite? Dominando o Desempenho em Altas Temperaturas vs. Risco de Contaminação
- O grafite é afetado pelo calor? Descubra Sua Notável Resistência e Estabilidade em Altas Temperaturas
- Quais são as aplicações industriais do grafite? Da Metalurgia aos Semicondutores
- Qual é a resistência à temperatura do grafite? Desvendando o seu potencial de alta temperatura no seu laboratório
- Por que o grafite não derrete? Desvendando os Segredos de Sua Extrema Resistência ao Calor



















