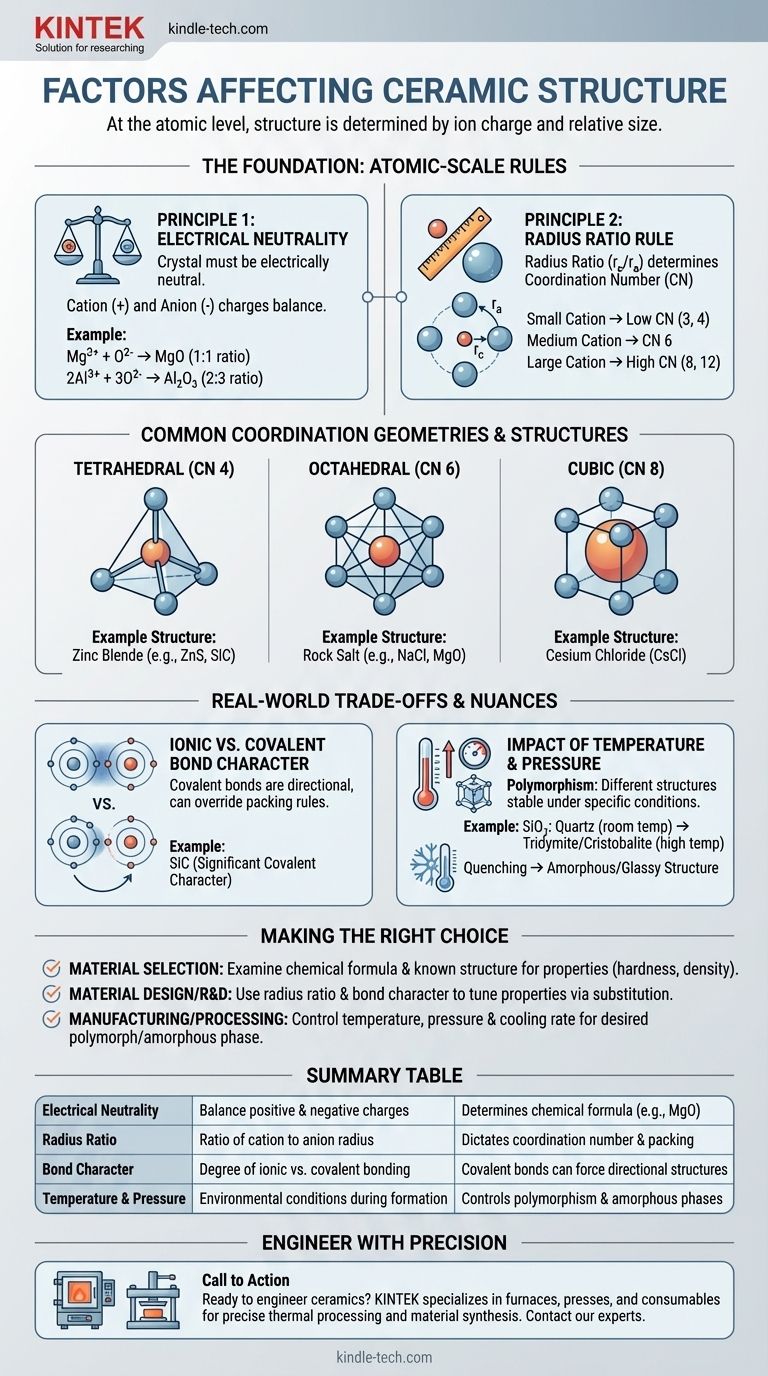
No nível atômico, a estrutura cristalina de uma cerâmica é determinada por dois fatores primários: a carga elétrica de seus íons constituintes e o tamanho relativo desses íons. Para formar uma estrutura estável e de baixa energia, o arranjo dos átomos deve satisfazer a neutralidade de carga, ao mesmo tempo em que se empacota da maneira mais geometricamente eficiente possível.
O desafio fundamental na formação de qualquer estrutura cristalina cerâmica é equilibrar forças concorrentes. Cátions e ânions se atraem, criando estruturas densas, mas seus tamanhos relativos ditam o arranjo geométrico específico – o número de coordenação – que pode ser fisicamente alcançado, mantendo a neutralidade elétrica geral.
A Base: Regras em Escala Atômica
Para entender por que uma cerâmica como o óxido de magnésio (MgO) forma uma estrutura enquanto o carboneto de silício (SiC) forma outra, devemos começar com as duas regras inegociáveis que governam como os átomos se organizam em uma rede cristalina estável.
Princípio 1: A Regra da Neutralidade Elétrica
O requisito mais fundamental é que o cristal deve ser eletricamente neutro. A soma de todas as cargas positivas dos cátions deve ser precisamente equilibrada pela soma de todas as cargas negativas dos ânions.
Este princípio dita a própria fórmula química. Por exemplo, como um íon de magnésio tem uma carga de +2 (Mg²⁺) e um íon de oxigênio tem uma carga de -2 (O²⁻), eles se combinam em uma proporção de 1:1 para formar MgO. Um íon de alumínio (Al³⁺) e um íon de oxigênio (O²⁻) devem se combinar em uma proporção de 2:3 para formar Al₂O₃ para alcançar a neutralidade.
Princípio 2: A Regra da Razão de Raios
Uma vez que a fórmula química é definida, a geometria assume o controle. A razão de raios – o raio do cátion (r_c) dividido pelo raio do ânion (r_a) – é o fator crítico que determina o número de coordenação (NC).
O número de coordenação é simplesmente o número de ânions que podem se empacotar em torno de um cátion central. Imagine tentar empacotar bolas de basquete (ânions) em torno de uma bola de tênis menor (cátion). Você só consegue encaixar algumas antes que elas comecem a se tocar. Se você substituir a bola de tênis por uma bola de futebol maior, poderá encaixar mais bolas de basquete ao redor dela. O tamanho relativo dita a geometria do empacotamento.
Do Empacotamento Atômico à Estrutura Cristalina
Esses dois princípios trabalham juntos para produzir os padrões repetitivos e tridimensionais que definem as estruturas cristalinas cerâmicas. A razão de raios prevê o número de coordenação, e a necessidade de neutralidade de carga então dita como essas unidades coordenadas se ligam no espaço.
Geometrias de Coordenação Comuns
Intervalos específicos de razão de raios sugerem fortemente um número de coordenação preferencial e sua forma correspondente:
- Um cátion pequeno resulta em um NC baixo, como 3 (triangular) ou 4 (tetraédrico).
- Um cátion de tamanho médio permite um NC de 6 (octaédrico).
- Um cátion grande, quase do tamanho do ânion, pode atingir um NC de 8 (cúbico) ou até 12.
Exemplos de Estruturas Cerâmicas Comuns
Essas regras dão origem a estruturas cristalinas bem conhecidas, nomeadas em homenagem a minerais comuns. Para cerâmicas do tipo AX simples (um cátion, um ânion):
- Estrutura de Sal-Gema (por exemplo, NaCl, MgO): Apresenta um número de coordenação de 6 para o cátion e o ânion. É uma estrutura altamente estável e comum quando o cátion e o ânion têm uma diferença de tamanho moderada.
- Estrutura de Cloreto de Césio (CsCl): Ocorre quando o cátion é quase tão grande quanto o ânion, permitindo um número de coordenação de 8 mais densamente empacotado.
- Estrutura de Blenda de Zinco (por exemplo, ZnS, SiC): Forma-se quando o cátion é significativamente menor que o ânion, resultando em um número de coordenação de 4 (tetraédrico). Esta estrutura também é característica de materiais com forte ligação covalente.
Para fórmulas mais complexas como AₘXₚ (por exemplo, Al₂O₃, CaF₂), os mesmos princípios se aplicam. A estrutura simplesmente se torna um arranjo mais intrincado para garantir que cada íon atinja sua coordenação preferida e a carga geral permaneça neutra.
Compreendendo as Trocas e Limitações
Embora esses princípios forneçam uma estrutura poderosa, eles são um modelo simplificado. Fatores do mundo real introduzem nuances importantes que podem alterar a estrutura final.
O Caráter da Ligação Iônica vs. Covalente
A regra da razão de raios funciona melhor para ligações puramente iônicas. No entanto, muitas cerâmicas, como o carboneto de silício (SiC) e o nitreto de silício (Si₃N₄), possuem um caráter covalente significativo.
As ligações covalentes são altamente direcionais. Os átomos preferem se ligar em ângulos específicos (por exemplo, 109,5° em um tetraedro). Nesses materiais, a necessidade de satisfazer ligações covalentes direcionais pode anular as regras de empacotamento geométrico da razão de raios, forçando uma estrutura específica como a coordenação tetraédrica.
O Impacto da Temperatura e Pressão
Um único composto químico pode frequentemente existir em múltiplas estruturas cristalinas diferentes, um fenômeno conhecido como polimorfismo. Cada uma dessas estruturas, ou polimorfos, é estável sob uma faixa específica de temperatura e pressão.
Por exemplo, a sílica (SiO₂) existe como quartzo à temperatura ambiente, mas se transforma em outros polimorfos como tridimita e cristobalita em temperaturas mais altas. Essas transformações envolvem um rearranjo dos átomos em uma nova estrutura, mais estável para essas condições.
Além disso, se uma cerâmica fundida for resfriada muito rapidamente (têmpera), os átomos podem não ter tempo suficiente para se organizar em uma rede cristalina ordenada. Isso resulta em uma estrutura desordenada, amorfa ou vítrea.
Fazendo a Escolha Certa para Sua Aplicação
Compreender esses fatores permite conectar o processamento e a composição de uma cerâmica à sua estrutura final e, em última análise, ao seu desempenho.
- Se o seu foco principal é a seleção de materiais: Comece examinando a fórmula química e a estrutura cristalina conhecida. Uma estrutura densa e de alta coordenação como o corindo (Al₂O₃) implica alta dureza e densidade, enquanto uma estrutura de menor coordenação pode ter propriedades diferentes.
- Se o seu foco principal é o design de materiais ou P&D: Use a razão de raios e o caráter da ligação como suas ferramentas. A substituição de átomos com tamanhos ou eletronegatividades diferentes pode ser usada para alterar intencionalmente a estrutura cristalina e ajustar suas propriedades.
- Se o seu foco principal é a fabricação e o processamento: Suas variáveis-chave são temperatura, pressão e taxa de resfriamento. Use-as para controlar qual polimorfo se forma ou para decidir entre um produto final cristalino e um amorfo.
Ao compreender a interação entre carga, tamanho e condições de processamento, você pode passar de simplesmente usar cerâmicas para projetá-las deliberadamente para um propósito específico.
Tabela Resumo:
| Fator | Descrição | Impacto Chave na Estrutura |
|---|---|---|
| Neutralidade Elétrica | As cargas positivas e negativas totais no cristal devem se equilibrar. | Determina a fórmula química (por exemplo, MgO, Al₂O₃). |
| Razão de Raios | A razão do raio do cátion para o raio do ânion (r_c/r_a). | Dita o número de coordenação e a geometria de empacotamento (por exemplo, tetraédrico, octaédrico). |
| Caráter da Ligação | O grau de ligação iônica vs. covalente. | As ligações covalentes podem forçar estruturas direcionais, anulando regras simples de empacotamento. |
| Temperatura e Pressão | As condições ambientais durante a formação e o processamento. | Controla o polimorfismo (diferentes formas cristalinas) e a formação de fases amorfas/vítreas. |
Pronto para projetar cerâmicas com precisão? O equipamento de laboratório certo é fundamental para controlar os fatores que definem a estrutura e o desempenho do seu material. A KINTEK é especializada em fornos, prensas e consumíveis que seu laboratório precisa para processamento térmico preciso e síntese de materiais. Entre em contato com nossos especialistas hoje para discutir como nossas soluções podem ajudá-lo a atingir seus objetivos específicos de material.
Guia Visual
Produtos relacionados
- Placa Cerâmica de Carboneto de Silício (SiC) Resistente ao Desgaste Engenharia Cerâmica Avançada Fina
- Chapa Cerâmica de Nitreto de Silício (SiN) Usinada de Precisão para Engenharia de Cerâmica Fina Avançada
- Peneiras de Teste de Laboratório e Máquinas de Peneiramento
- Esfera Cerâmica de Zircônia Usinada de Precisão para Cerâmicas Finas Avançadas de Engenharia
- Dissipador de Calor de Óxido de Alumínio Al2O3 Avançado de Cerâmica Fina para Isolamento
As pessoas também perguntam
- Qual é a resistência à temperatura do carbeto de silício? Suporta Calor Extremo Até 1500°C
- Qual é mais duro, o carboneto de silício ou o carboneto de tungstênio? Descubra a chave para a seleção de materiais
- Qual é a cerâmica mais resistente? O Carbeto de Silício Lidera em Dureza e Resistência Térmica
- Quais são as características do SiC? Desbloqueie o Desempenho em Altas Temperaturas, Duro e Quimicamente Inerte
- O carboneto de silício é resistente ao calor? Desbloqueie um Desempenho Superior em Temperaturas Extremas



















