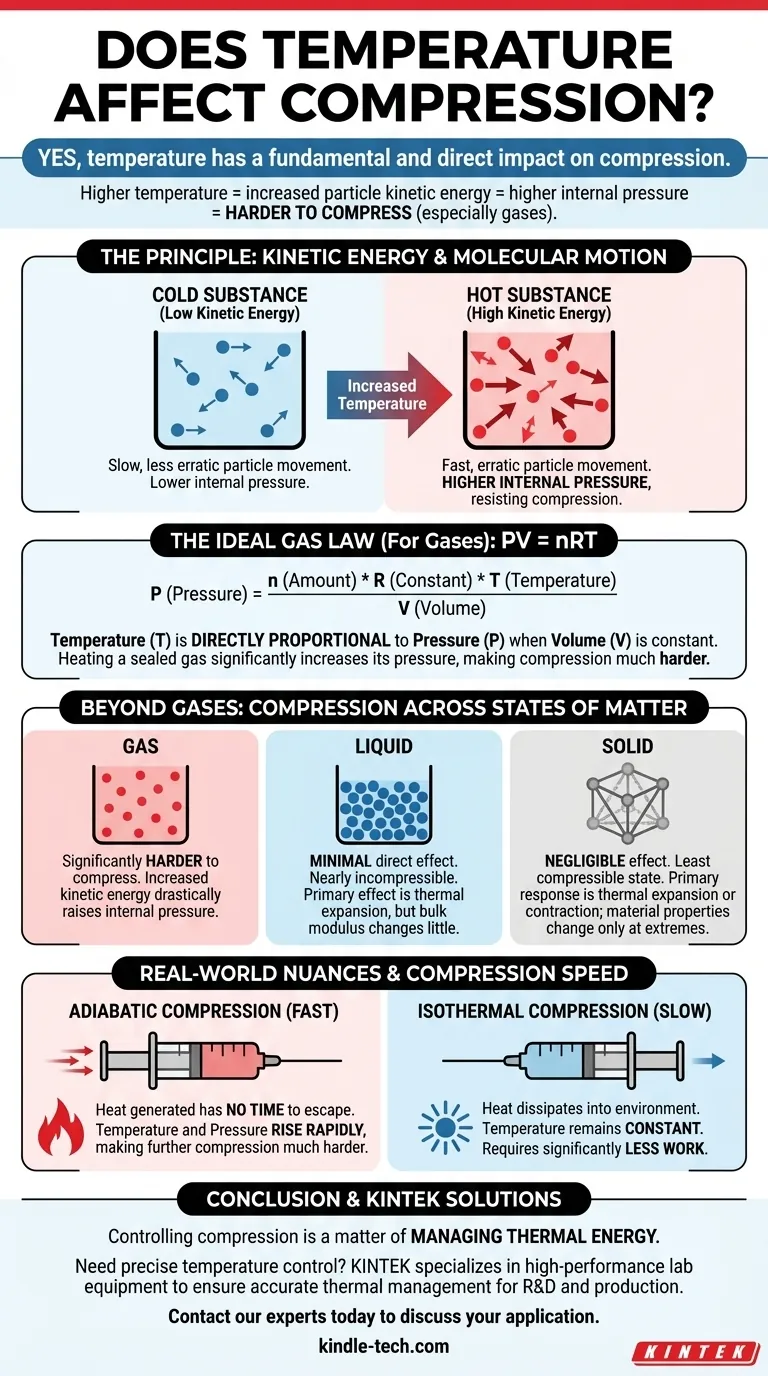
Sim, a temperatura tem um impacto fundamental e direto na compressão. Para os gases em particular, à medida que você aumenta a temperatura de uma substância, suas partículas ganham energia cinética, movem-se mais rapidamente e empurram para fora com maior força. Essa pressão interna aumentada torna a substância significativamente mais difícil de comprimir.
O princípio central é uma relação direta entre energia e pressão. Temperaturas mais altas significam mais energia das partículas, o que cria uma pressão interna maior que você deve superar para comprimir uma substância, especialmente um gás. Essa relação é um pilar da termodinâmica.

O Princípio: Energia Cinética e Movimento Molecular
Para entender por que a temperatura afeta a compressão, precisamos observar o que acontece no nível molecular.
O Que a Temperatura Representa
A temperatura não é uma propriedade abstrata; é uma medida direta da energia cinética média dos átomos ou moléculas dentro de uma substância.
Partículas mais quentes movem-se mais rapidamente e de forma mais errática. Partículas mais frias movem-se mais lentamente.
Como a Energia Cinética Resiste à Compressão
Quando você comprime uma substância, você está forçando suas partículas a se aproximarem. A energia cinética dessas partículas cria uma pressão interna que se opõe a essa força externa.
Em um gás quente, as partículas em movimento rápido colidem com as paredes de seu recipiente com mais frequência e com maior força. Para reduzir o volume, você deve aplicar uma força externa significativamente maior para superar essa poderosa pressão interna.
Quantificando a Relação: A Lei dos Gases Ideais
Para os gases, essa relação é elegantemente descrita por um princípio fundamental na física e na química.
A Fórmula: PV = nRT
A Lei dos Gases Ideais fornece um modelo matemático para o comportamento da maioria dos gases em condições comuns. A fórmula é PV = nRT, onde:
- P é a pressão
- V é o volume
- n é a quantidade de gás
- R é a constante dos gases ideais
- T é a temperatura
O Papel Direto da Temperatura
Nesta equação, a temperatura (T) é diretamente proporcional à pressão (P) se o volume for mantido constante.
Isso significa que, se você pegar um recipiente selado de ar e aquecê-lo, a pressão interna aumentará. Esse aumento de pressão é a própria resistência que você sente ao tentar comprimir um gás quente.
Uma Analogia Simples: Uma Bomba de Bicicleta
Quando você usa uma bomba manual para encher um pneu, você está comprimindo o ar rapidamente. Você notará que o cilindro da bomba esquenta.
Isso não é apenas devido ao atrito. Você está realizando trabalho sobre o gás, o que aumenta sua energia interna e, portanto, sua temperatura. Esse efeito, conhecido como aquecimento adiabático, torna o ar mais difícil de comprimir à medida que você bombeia mais rápido.
Além dos Gases: Líquidos e Sólidos
Embora o efeito seja mais dramático nos gases, a temperatura também influencia a compressão de líquidos e sólidos, embora de maneiras diferentes.
O Caso dos Líquidos
Os líquidos são considerados quase incompressíveis. Suas moléculas já estão em contato próximo, deixando pouco espaço livre.
O principal efeito da temperatura em um líquido é a expansão térmica. Aquecer um líquido fará com que ele se expanda ligeiramente, mas sua resistência à compressão (seu módulo de compressibilidade) não muda tão drasticamente quanto para um gás.
O Comportamento dos Sólidos
Os sólidos são o estado da matéria menos compressível. Assim como os líquidos, sua resposta primária à mudança de temperatura é a expansão ou contração térmica.
Embora temperaturas extremas possam afetar as propriedades materiais de um sólido, como a rigidez, o impacto direto em sua compressibilidade é insignificante na maioria dos cenários de engenharia em comparação com o efeito nos gases.
Armadilhas Comuns e Nuances do Mundo Real
A Lei dos Gases Ideais é um modelo poderoso, mas as aplicações do mundo real apresentam complexidades importantes.
Gás Ideal vs. Gás Real
A Lei dos Gases Ideais assume que as partículas de gás não têm volume e não têm atrações intermoleculares. Esta é uma simplificação útil, mas os gases reais desviam-se deste modelo em pressões muito altas ou temperaturas muito baixas.
Compressão Adiabática vs. Isotérmica
A velocidade da compressão importa imensamente.
- Compressão Adiabática (Rápida): Quando você comprime um gás rapidamente, o calor gerado não tem tempo para escapar. Esse aumento de temperatura eleva a pressão interna, tornando a compressão adicional muito mais difícil.
- Compressão Isotérmica (Lenta): Se você comprimir um gás muito lentamente, o calor pode se dissipar no ambiente, mantendo a temperatura constante. Isso requer significativamente menos trabalho do que a compressão adiabática.
Fazendo a Escolha Certa para o Seu Objetivo
Sua abordagem depende inteiramente do que você está tentando alcançar.
- Se o seu foco principal é projetar um sistema pneumático ou hidráulico: Você deve gerenciar ativamente o calor. O aumento de temperatura da compressão rápida (aquecimento adiabático) aumentará significativamente a força necessária e pode afetar as vedações e a viscosidade do fluido.
- Se o seu foco principal é gerenciar recipientes selados e pressurizados: Você deve considerar as oscilações da temperatura ambiente. Um tanque cheio em uma manhã fria experimentará um aumento significativo de pressão ao sol da tarde, o que pode se tornar um fator crítico de segurança.
- Se o seu foco principal é entender a física central: Comece com a Lei dos Gases Ideais (PV=nRT). É o modelo essencial para compreender a relação direta e previsível entre temperatura, pressão e volume.
Em última análise, a temperatura é uma forma de energia, e controlar a compressão é uma questão de gerenciar essa energia.
Tabela Resumo:
| Estado da Matéria | Efeito do Aumento da Temperatura na Compressão | Princípio Chave |
|---|---|---|
| Gás | Significativamente mais difícil de comprimir | Lei dos Gases Ideais (PV=nRT); o aumento da energia cinética eleva a pressão interna. |
| Líquido | Efeito direto mínimo na compressibilidade (quase incompressível) | O efeito primário é a expansão térmica; o módulo de compressibilidade muda pouco. |
| Sólido | Efeito insignificante na compressibilidade na maioria dos cenários | O efeito primário é a expansão/contração térmica; as propriedades do material podem mudar em extremos. |
Precisa de controle preciso de temperatura para seus processos de compressão?
Compreender a termodinâmica da compressão é crucial para P&D, controle de qualidade e otimização de processos. A KINTEK é especializada em equipamentos de laboratório de alto desempenho, incluindo estufas, fornos e sistemas de controle de temperatura, projetados para ajudá-lo a gerenciar com precisão a energia térmica em seus experimentos e produção.
Deixe nossos especialistas ajudá-lo a selecionar o equipamento certo para garantir resultados confiáveis e repetíveis. Entre em contato com nossa equipe técnica hoje mesmo para discutir suas necessidades específicas de aplicação.
Guia Visual
Produtos relacionados
- Máquina CIP de Prensagem Isostática a Frio para Laboratório para Prensagem Isostática a Frio
- Máquina Automática de Prensa Isostática a Frio de Laboratório Prensagem Isostática a Frio
- Máquina Manual de Prensagem Isostática a Frio CIP Prensadora de Pelotas
- Prensa Isostática a Quente WIP Estação de Trabalho 300Mpa para Aplicações de Alta Pressão
- Máquina de Prensagem Hidráulica Manual de Alta Temperatura com Placas Aquecidas para Laboratório
As pessoas também perguntam
- Qual é o processo do grafite isostático? Um Guia para a Criação de Material Uniforme e de Alto Desempenho
- Qual é a diferença entre sinterização e prensagem? Um Guia para Processos de Metalurgia do Pó
- Quais são as aplicações da prensagem isostática a frio? Obtenha Densidade Uniforme para Peças Complexas
- Quanto custa uma prensa isostática? Um Guia de Preços para Laboratório vs. Industrial
- Por que a conformação a frio é melhor do que a conformação a quente? Um guia para escolher o processo de conformação de metal correto



















