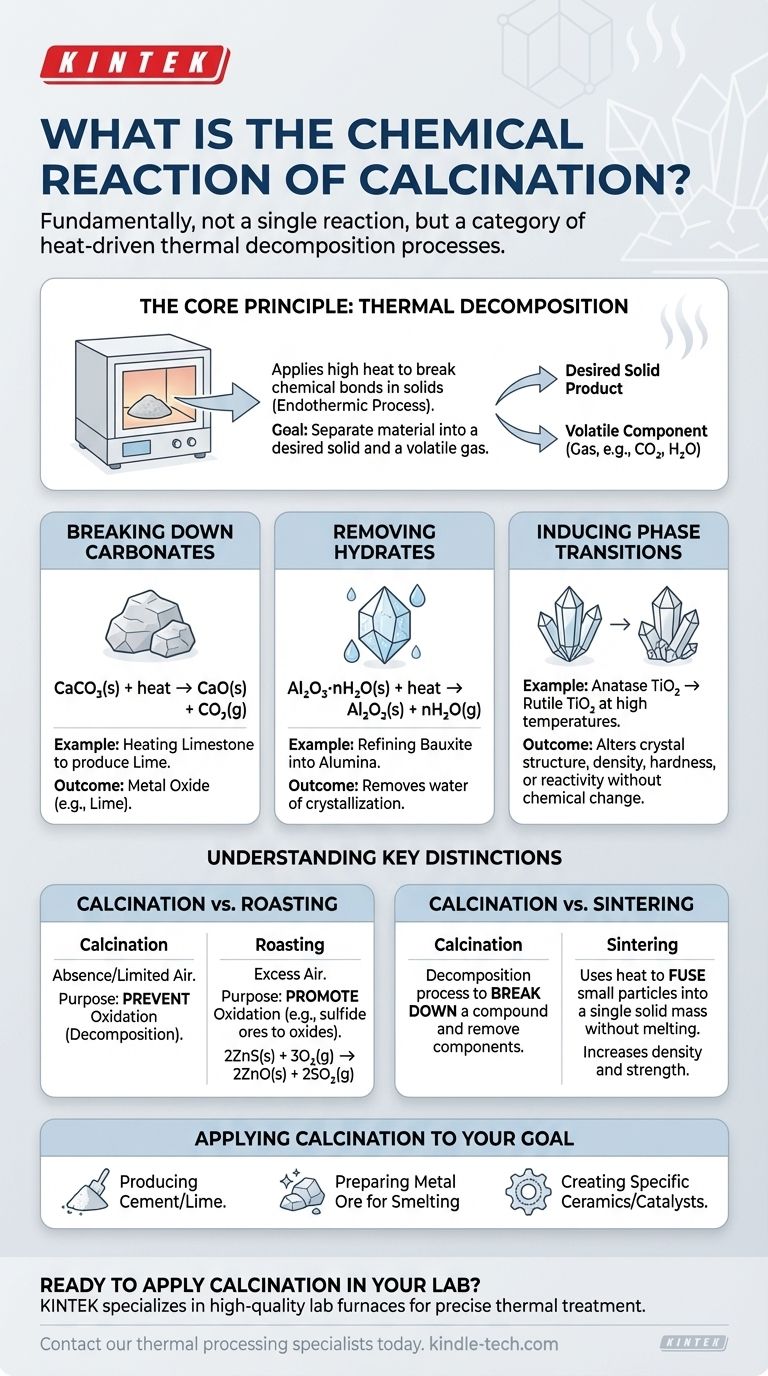
Fundamentalmente, a calcinação não é uma única reação química, mas sim uma categoria de processos impulsionados pelo calor definidos por um resultado específico: a decomposição térmica. Embora muitas reações se enquadrem neste guarda-chuva, o exemplo mais comum é a decomposição de um carbonato, como o aquecimento de calcário (carbonato de cálcio) para produzir cal (óxido de cálcio) e gás dióxido de carbono.
A calcinação é um processo de tratamento térmico que utiliza alta temperatura em uma atmosfera controlada para decompor um material. Seu principal objetivo é expelir um componente volátil — como dióxido de carbono ou água — para purificar ou alterar as propriedades químicas e físicas do sólido restante.

O Princípio Central: Decomposição Térmica
A calcinação funciona aplicando energia térmica suficiente a um sólido para quebrar suas ligações químicas. Este processo é sempre endotérmico, o que significa que requer uma entrada de energia (calor) para ocorrer. O objetivo é separar o material em um produto sólido desejado e um componente volátil que pode ser expelido como gás.
Decomposição de Carbonatos
Esta é a aplicação clássica e mais difundida da calcinação, particularmente na produção de cimento. Quando um carbonato metálico é aquecido, ele se decompõe em um óxido metálico e gás dióxido de carbono.
Para o calcário, a reação é:
CaCO₃(s) + calor → CaO(s) + CO₂(g)
Aqui, o carbonato de cálcio sólido se decompõe em óxido de cálcio sólido (cal) e dióxido de carbono gasoso.
Remoção de Hidratos (Água de Cristalização)
Muitos minerais existem como hidratos, o que significa que moléculas de água são incorporadas em sua estrutura cristalina. A calcinação é usada para expelir essa água, um processo frequentemente chamado de "secagem", embora seja uma decomposição química.
Por exemplo, o refino do minério de bauxita em alumina envolve a calcinação do óxido de alumínio hidratado:
Al₂O₃·nH₂O(s) + calor → Al₂O₃(s) + nH₂O(g)
Esta etapa remove a água, concentrando o óxido de alumínio, que é um precursor necessário para a produção de metal alumínio.
Indução de Transições de Fase
Menos comumente, a calcinação pode se referir a um processo onde o calor não causa decomposição, mas sim altera a estrutura cristalina (fase) de um material. Isso altera suas propriedades físicas, como densidade, dureza ou reatividade, sem alterar sua fórmula química.
Um exemplo é a conversão de anatásio, uma forma de dióxido de titânio (TiO₂), em sua fase rutilo mais estável em altas temperaturas.
Compreendendo as Distinções Chave
O valor da calcinação torna-se mais claro quando contrastado com outros processos térmicos comuns. As condições específicas — particularmente a atmosfera — definem o resultado.
Calcinação vs. Torrefação
Esta é a distinção mais crítica. A calcinação ocorre na ausência ou suprimento limitado de ar para propositadamente prevenir a oxidação.
A torrefação, por outro lado, é feita em excesso de ar especificamente para promover a oxidação. É tipicamente usada em minérios de sulfeto, convertendo-os em óxidos. Por exemplo, a torrefação de sulfeto de zinco:
2ZnS(s) + 3O₂(g) → 2ZnO(s) + 2SO₂(g)
Calcinação vs. Sinterização
Esses processos têm objetivos opostos. A calcinação é um processo de decomposição usado para quebrar um composto e remover um componente.
A sinterização, no entanto, usa calor (abaixo do ponto de fusão) para fundir pequenas partículas em uma única massa sólida. Ela aumenta a densidade e a resistência, essencialmente "soldando" o material sem derretê-lo.
Aplicando a Calcinação ao Seu Objetivo
A reação de calcinação específica que lhe interessa depende inteiramente do seu material de partida e do produto final desejado.
- Se o seu foco principal é a produção de cimento ou cal: Você está usando a calcinação para decompor o carbonato de cálcio em óxido de cálcio reativo.
- Se o seu foco principal é a preparação de um minério metálico para fundição: Você provavelmente está usando a calcinação para remover água (de hidratos) ou dióxido de carbono (de carbonatos) para enriquecer o teor de metal.
- Se o seu foco principal é a criação de uma cerâmica ou catalisador específico: Você pode estar usando a calcinação para atingir uma fase cristalina e área de superfície desejadas em um material como alumina ou titânia.
Em última análise, a calcinação é uma ferramenta fundamental na ciência dos materiais para transformar sólidos brutos em formas mais úteis, concentradas ou reativas.
Tabela Resumo:
| Tipo de Reação de Calcinação | Exemplo de Reação | Resultado Chave |
|---|---|---|
| Decomposição de Carbonato | CaCO₃(s) + calor → CaO(s) + CO₂(g) |
Produz óxido metálico (ex: cal) |
| Decomposição de Hidrato | Al₂O₃·nH₂O(s) + calor → Al₂O₃(s) + nH₂O(g) |
Remove água de cristalização |
| Transição de Fase | Anatásio TiO₂ → Rutilo TiO₂ | Altera a estrutura cristalina e propriedades |
Pronto para aplicar a calcinação em seu laboratório?
Seja você desenvolvendo novos catalisadores, processando minérios ou sintetizando cerâmicas avançadas, o tratamento térmico preciso é crítico. A KINTEK é especializada em fornos de laboratório e equipamentos de alta qualidade projetados para processos de calcinação confiáveis.
Fornecemos as ferramentas de que você precisa para obter aquecimento uniforme, controle preciso de temperatura e resultados consistentes. Deixe nossos especialistas ajudá-lo a selecionar o equipamento certo para seu material e aplicação específicos.
Entre em contato com nossos especialistas em processamento térmico hoje para discutir os requisitos do seu projeto e descobrir como a KINTEK pode aprimorar sua pesquisa e desenvolvimento.
Guia Visual
Produtos relacionados
- Máquina de Forno de Pirólise de Forno Rotativo Elétrico Calciner Forno Rotativo Pequeno
- Forno Rotativo Elétrico de Trabalho Contínuo, Pequeno Forno Rotativo, Planta de Pirólise de Aquecimento
- Forno Rotativo Elétrico para Regeneração de Carvão Ativado
- Fornalha Rotativa de Tubo de Trabalho Contínuo Selada a Vácuo
- Forno de Tubo de Quartzo para Processamento Térmico Rápido (RTP) de Laboratório
As pessoas também perguntam
- Quais são as aplicações industriais da pirólise? Transformar Resíduos em Energia e Produtos Valiosos
- Quais são as zonas do forno rotativo na produção de cimento? Domine o Processo Essencial para Clínquer de Alta Qualidade
- Qual é o propósito de um calcinador? Aumente a Eficiência no Processamento de Alta Temperatura
- Qual é o princípio do forno rotativo? Dominando o Processamento Térmico Contínuo
- Que biomassa é usada na pirólise? Selecionando a matéria-prima ideal para seus objetivos



















