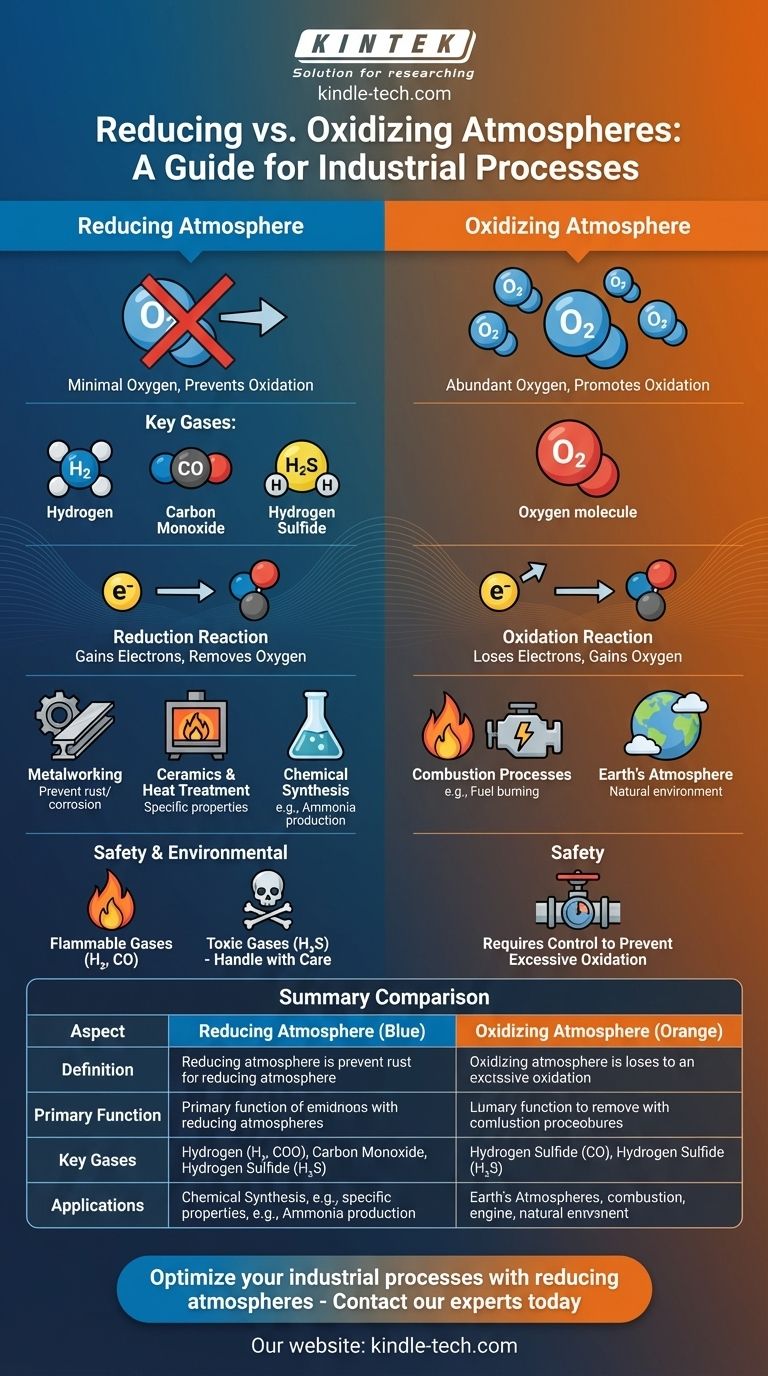
Uma atmosfera redutora é um ambiente gasoso onde a presença de oxigénio e outros agentes oxidantes é minimizada ou removida, prevenindo processos de oxidação. Em vez disso, contém gases como hidrogénio, monóxido de carbono e sulfureto de hidrogénio, que promovem reações de redução. Este tipo de atmosfera é frequentemente utilizado em processos industriais, como metalurgia e cerâmica, para prevenir a oxidação e alcançar propriedades específicas dos materiais. Por outro lado, uma atmosfera oxidante contém oxigénio abundante, facilitando as reações de oxidação. Compreender a distinção entre estas atmosferas é crucial para aplicações em ciência dos materiais, fabrico e estudos ambientais.

Pontos Chave Explicados:
-
Definição de uma Atmosfera Redutora:
- Uma atmosfera redutora é caracterizada pela ausência ou presença mínima de oxigénio e outros gases oxidantes.
- Contém gases como hidrogénio (H₂), monóxido de carbono (CO) e sulfureto de hidrogénio (H₂S), que são capazes de doar eletrões e promover reações de redução.
- As reações de redução envolvem o ganho de eletrões por uma substância, muitas vezes levando à remoção de oxigénio de compostos.
-
Propósito e Aplicações:
- Prevenção da Oxidação: Uma atmosfera redutora é utilizada para prevenir a oxidação, que pode degradar materiais ou alterar as suas propriedades. Por exemplo, na metalurgia, ajuda a manter a integridade dos metais, prevenindo a ferrugem ou corrosão.
- Processos Industriais: É essencial em processos como recozimento, sinterização e tratamento térmico de metais e cerâmicas, onde são necessárias atmosferas controladas para alcançar características específicas dos materiais.
- Reações Químicas: Na síntese química, uma atmosfera redutora pode facilitar reações que requerem a redução de compostos, como a produção de amoníaco (NH₃) a partir de azoto (N₂) e hidrogénio (H₂).
-
Comparação com a Atmosfera Oxidante:
- Atmosfera Oxidante: Este ambiente contém oxigénio abundante, promovendo reações de oxidação onde as substâncias perdem eletrões. É comum em processos de combustão e ambientes como a atmosfera terrestre.
-
Diferenças Chave:
- As atmosferas redutoras previnem a oxidação, enquanto as atmosferas oxidantes a promovem.
- As atmosferas redutoras são usadas em processos onde a oxidação é indesejável, enquanto as atmosferas oxidantes são usadas onde a oxidação é necessária, como na combustão de combustível.
-
Exemplos de Gases Redutores:
- Hidrogénio (H₂): Um gás altamente reativo que doa eletrões prontamente, tornando-o um forte agente redutor.
- Monóxido de Carbono (CO): Frequentemente utilizado em ambientes industriais para reduzir óxidos metálicos a metais puros.
- Sulfureto de Hidrogénio (H₂S): Um gás redutor que pode participar em reações de redução, embora seja menos comummente utilizado devido à sua toxicidade.
-
Considerações Ambientais e de Segurança:
- Manuseio de Gases Redutores: Muitos gases redutores, como hidrogénio e monóxido de carbono, são inflamáveis e requerem manuseio cuidadoso para prevenir explosões ou incêndios.
- Toxicidade: Alguns gases redutores, como o sulfureto de hidrogénio, são tóxicos e exigem ventilação adequada e protocolos de segurança.
- Impacto Ambiental: O uso de atmosferas redutoras em processos industriais deve ser gerido para minimizar danos ambientais, como a libertação de subprodutos nocivos.
-
Papel em Ambientes Naturais e Industriais:
- Atmosferas Redutoras Naturais: Raras na Terra, mas podem ocorrer em ambientes específicos, como fontes hidrotermais de águas profundas ou certos habitats microbianos.
- Atmosferas Redutoras Industriais: Comumente criadas em ambientes controlados para processos de fabrico, como em fornos ou reatores, para alcançar as propriedades desejadas do material ou reações químicas.
Ao compreender os princípios e aplicações das atmosferas redutoras e oxidantes, as indústrias podem otimizar processos, melhorar o desempenho dos materiais e garantir a segurança e a conformidade ambiental.
Tabela Resumo:
| Aspeto | Atmosfera Redutora | Atmosfera Oxidante |
|---|---|---|
| Definição | Oxigénio mínimo, contém gases redutores (ex: H₂, CO, H₂S) | Oxigénio abundante, promove reações de oxidação |
| Função Primária | Previne a oxidação, promove reações de redução | Facilita reações de oxidação |
| Aplicações | Metalurgia, cerâmica, síntese química, tratamento térmico | Processos de combustão, atmosfera terrestre |
| Gases Chave | Hidrogénio (H₂), Monóxido de Carbono (CO), Sulfureto de Hidrogénio (H₂S) | Oxigénio (O₂) |
| Considerações de Segurança | Gases inflamáveis (ex: H₂, CO), gases tóxicos (ex: H₂S) requerem manuseio cuidadoso | Menos perigoso, mas requer controlo para prevenir oxidação excessiva |
Otimize os seus processos industriais com atmosferas redutoras — contacte os nossos especialistas hoje para soluções personalizadas!
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é a diferença entre uma atmosfera redutora e uma atmosfera comum? Controle a oxidação para melhores resultados
- Qual é a função de um ambiente de argônio de alta pureza durante a ceramição in-situ? Garante Fases Cerâmicas Endurecidas
- Por que um forno de oxidação a vapor de alta temperatura é essencial para o teste de desempenho de revestimentos de combustível de cromo?
- Como um forno de atmosfera de tubo garante a atividade de metais nobres na preparação de catalisadores de Pt/Al2O3 suportados?
- O que é um forno de recozimento de hidrogênio de alta temperatura? Desbloqueie a Pureza Máxima e a Força de Ligação
- Por que um sistema de controle de atmosfera fornecendo nitrogênio de alta pureza é essencial para processos de torrefação de biomassa?
- Por que o árgon é um material adequado para ser usado quando uma atmosfera inerte é necessária? O Guia Definitivo para a Seleção de Gás Inerte
- Quais são as desvantagens de um sistema de gás inerte? Compreendendo os Riscos de Segurança e Operacionais



















