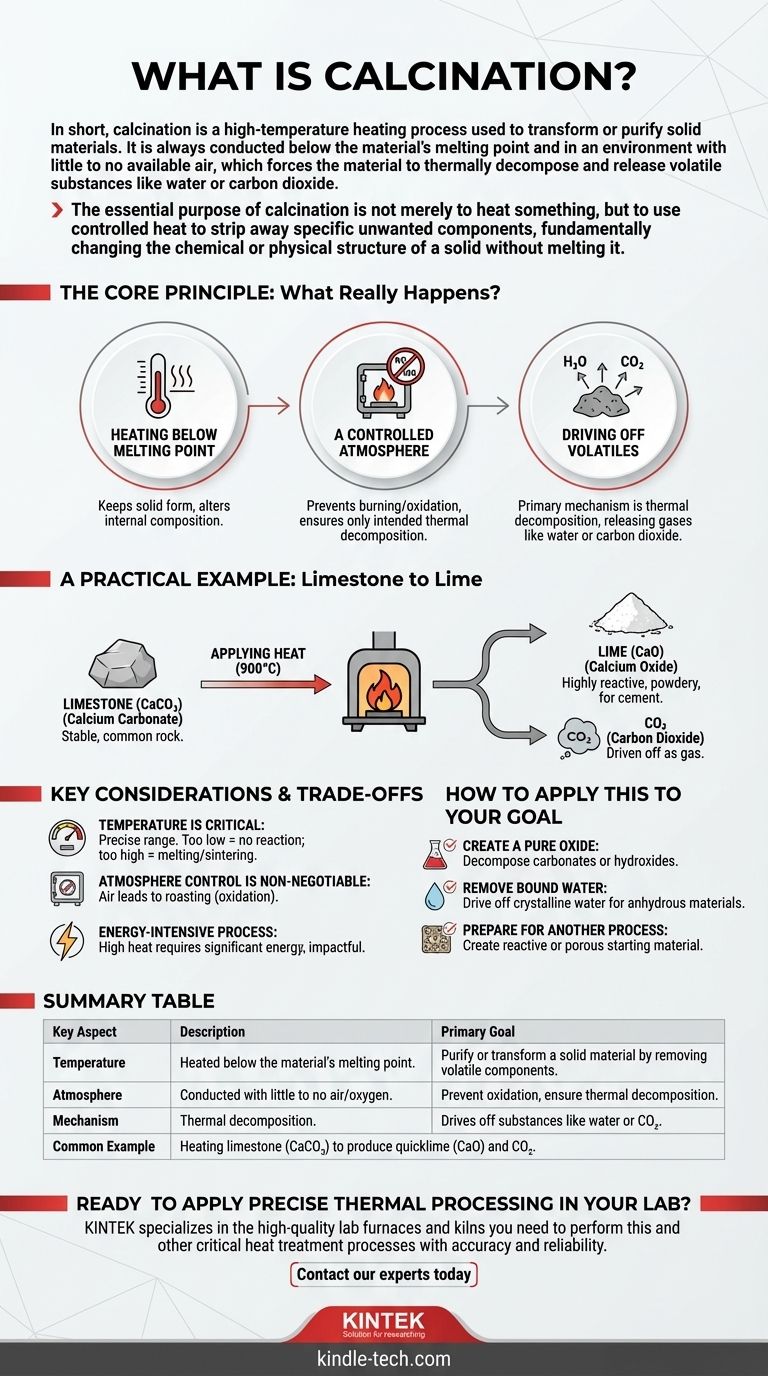
Em resumo, calcinação é um processo de aquecimento a alta temperatura usado para transformar ou purificar materiais sólidos. É sempre conduzido abaixo do ponto de fusão do material e em um ambiente com pouco ou nenhum ar disponível, o que força o material a se decompor termicamente e liberar substâncias voláteis como água ou dióxido de carbono.
O propósito essencial da calcinação não é meramente aquecer algo, mas usar calor controlado para remover componentes indesejados específicos, alterando fundamentalmente a estrutura química ou física de um sólido sem derretê-lo.

O Princípio Central: O que realmente acontece durante a calcinação?
Para entender a calcinação, é crucial olhar além do simples ato de aquecer. O processo é definido por três condições específicas que trabalham juntas para alcançar um resultado preciso.
Aquecimento Abaixo do Ponto de Fusão
O objetivo é induzir mudanças químicas ou físicas dentro do próprio material sólido. Ao manter a temperatura abaixo do seu ponto de fusão, a forma sólida geral do material é mantida enquanto sua composição interna é alterada.
Uma Atmosfera Controlada
A calcinação é realizada na ausência ou com um suprimento muito limitado de ar (oxigênio). Esta é uma distinção crítica. Impede que o material queime ou oxide, garantindo que a única reação que ocorra seja a decomposição térmica pretendida.
Eliminação de Voláteis
O mecanismo principal é a decomposição térmica. O calor aplicado fornece a energia necessária para quebrar as ligações químicas, forçando o material a liberar frações voláteis. Estas são tipicamente substâncias que podem se tornar um gás, como água (H₂O) ou dióxido de carbono (CO₂).
Um Exemplo Prático: Do Calcário à Cal Viva
O exemplo mais comum e facilmente compreendido de calcinação é seu papel na produção de cal para a indústria de cimento.
O Material de Partida: Calcário
O processo começa com calcário, que quimicamente é conhecido como carbonato de cálcio (CaCO₃). É uma rocha estável e comum.
O Processo: Aplicação de Calor
O calcário é aquecido em um grande forno a temperaturas em torno de 900°C (1650°F). Este calor intenso decompõe o carbonato de cálcio.
Os Produtos Finais: Cal Viva e CO₂
O processo de calcinação elimina o dióxido de carbono (CO₂) como um gás, deixando para trás uma substância pulverulenta altamente reativa conhecida como óxido de cálcio (CaO), ou cal viva. Esta cal resultante é um ingrediente fundamental no cimento e em outras aplicações industriais.
Considerações Chave e Compensações
Embora poderosa, a calcinação é um processo que exige precisão. O mal-entendido de seus requisitos centrais pode levar a resultados falhos ou ineficientes.
A Temperatura é Crítica
O processo opera dentro de uma janela de temperatura específica. Se a temperatura for muito baixa, a reação de decomposição não ocorrerá. Se for muito alta, o material pode derreter ou sinterizar (fundir-se em uma massa sólida), o que pode ser indesejável para a aplicação final.
O Controle da Atmosfera Não é Negociável
Permitir a entrada de ar não controlado no forno mudaria completamente o processo. Por exemplo, aquecer um sulfeto metálico na presença de ar é chamado de torrefação, um processo de oxidação com um resultado completamente diferente da calcinação.
É um Processo Intensivo em Energia
Aquecer grandes quantidades de material a temperaturas tão elevadas requer uma quantidade significativa de energia. Isso torna a calcinação uma etapa custosa e de impacto ambiental em qualquer fluxo de trabalho industrial.
Como Aplicar Isso ao Seu Objetivo
Entender quando e por que usar a calcinação é fundamental para alavancá-la efetivamente na ciência dos materiais, química e engenharia.
- Se o seu foco principal é criar um óxido puro: A calcinação é o método definitivo para decompor carbonatos (como o calcário) ou hidróxidos para produzir seus óxidos correspondentes.
- Se o seu foco principal é remover água ligada: O processo é usado para eliminar a água cristalina de minerais hidratados, criando uma versão anidra (livre de água) do material.
- Se o seu foco principal é preparar um material para outro processo: A calcinação é frequentemente uma etapa preparatória crucial para criar um material de partida mais reativo ou poroso para reações químicas subsequentes.
Em última análise, a calcinação é uma ferramenta industrial precisa para usar calor controlado para purificar e transformar fundamentalmente materiais sólidos.
Tabela de Resumo:
| Aspecto Chave | Descrição |
|---|---|
| Objetivo Principal | Purificar ou transformar um material sólido removendo componentes voláteis. |
| Temperatura | Aquecido abaixo do ponto de fusão do material. |
| Atmosfera | Conduzido com pouco ou nenhum ar/oxigênio para evitar oxidação. |
| Mecanismo | A decomposição térmica elimina substâncias como água ou CO₂. |
| Exemplo Comum | Aquecimento de calcário (CaCO₃) para produzir cal viva (CaO) e CO₂. |
Pronto para aplicar processamento térmico preciso no seu laboratório?
A calcinação é uma etapa fundamental para criar óxidos puros, remover água e preparar materiais reativos. A KINTEK é especializada nos fornos e muflas de alta qualidade que você precisa para realizar este e outros processos críticos de tratamento térmico com precisão e confiabilidade.
Entre em contato com nossos especialistas hoje mesmo para encontrar a solução de calcinação perfeita para os materiais e objetivos específicos do seu laboratório.
Guia Visual
Produtos relacionados
- Forno de Tubo de Alta Temperatura de Laboratório de 1700℃ com Tubo de Alumina
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno de Mufla de 1700℃ para Laboratório
- Forno de Grafitação a Vácuo de Ultra-Alta Temperatura de Grafite
- Forno de Sinterização e Brasagem por Tratamento Térmico a Vácuo
As pessoas também perguntam
- Qual é a temperatura de alta temperatura do tubo de cerâmica? De 1100°C a 1800°C, Escolha o Material Certo
- Como limpar um tubo de forno tubular? Um Guia Passo a Passo para uma Limpeza Segura e Eficaz
- Para que serve um forno tubular? Aquecimento de Precisão para Síntese e Análise de Materiais
- Quais são as vantagens de usar um revestimento de alumina em um forno tubular para simulações de corrosão de combustão de biomassa?
- Qual é o papel dos tubos de corindo nos testes de permeação de oxigênio? Garanta a integridade para membranas dopadas com Bi



















