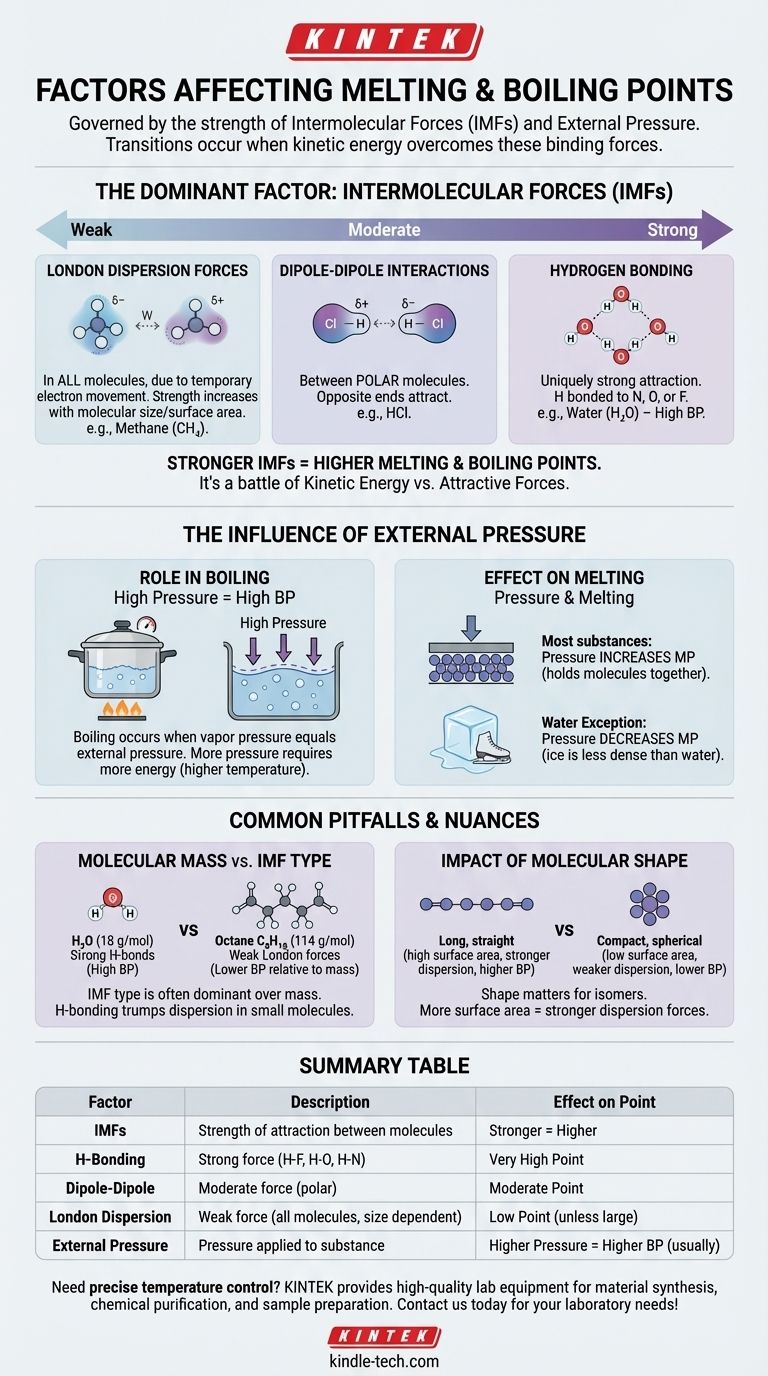
Em um nível fundamental, os pontos de fusão e ebulição de uma substância são regidos por dois fatores principais: a força das forças intermoleculares (FIMs) que mantêm suas moléculas unidas e a pressão externa aplicada a ela. Essencialmente, essas transições ocorrem quando as moléculas ganham energia suficiente para superar as forças que as ligam e a pressão que as contém.
A principal conclusão é que a fusão e a ebulição não se tratam apenas de temperatura; elas são uma batalha física entre a energia cinética de uma molécula e as forças atrativas que a mantêm ligada aos seus vizinhos. Quanto mais fortes essas atrações, mais energia é necessária para quebrá-las.

O Fator Dominante: Forças Intermoleculares (FIMs)
O fator mais importante na determinação dos pontos de fusão e ebulição de uma substância é a força das atrações entre suas moléculas individuais. Estas não são as fortes ligações covalentes dentro de uma molécula, mas sim as forças mais fracas que fazem as moléculas se aderirem umas às outras.
O Que São Forças Intermoleculares?
Pense nas FIMs como o equivalente molecular de ímãs. Algumas moléculas são como eletroímãs potentes, enquanto outras são como ímãs de geladeira fracos. Superar essa "aderência" requer energia na forma de calor.
A Hierarquia das Forças
As forças intermoleculares variam em intensidade, criando uma hierarquia clara. Entender essa hierarquia é fundamental para prever quais substâncias terão pontos de ebulição mais altos ou mais baixos.
Ligação de Hidrogênio (Mais Forte) Este é um tipo de atração excepcionalmente forte que ocorre quando o hidrogênio está ligado a um átomo altamente eletronegativo como nitrogênio (N), oxigênio (O) ou flúor (F). A água ($\text{H}_2\text{O}$) é o exemplo clássico, e suas poderosas ligações de hidrogênio são a razão pela qual ela tem um ponto de ebulição notavelmente alto para seu pequeno tamanho.
Interações Dipolo-Dipolo (Moderadas) Essas forças existem entre moléculas polares — moléculas que têm uma carga parcial positiva permanente em uma extremidade e uma carga parcial negativa na outra. Essas extremidades opostas se atraem, mantendo a substância unida de forma moderada.
Forças de Dispersão de London (Mais Fracas) Essas forças existem em todas as moléculas, causadas pelo movimento temporário e aleatório de elétrons que cria dipolos fugazes. Embora fracas individualmente, elas se tornam mais significativas à medida que o tamanho e a área de superfície da molécula aumentam. É por isso que moléculas maiores como o octano ($\text{C}_8\text{H}_{18}$) são líquidas à temperatura ambiente, enquanto as menores como o metano ($\text{CH}_4$) são gases.
A Influência da Pressão Externa
A pressão externa atua como uma tampa física sobre uma substância, dificultando que as moléculas escapem para a próxima fase (de sólido para líquido, ou de líquido para gás).
O Papel da Pressão na Ebulição
A ebulição ocorre quando a pressão de vapor interna de um líquido iguala a pressão atmosférica externa.
Se você aumentar a pressão externa (por exemplo, usando uma panela de pressão), você aumenta o ponto de ebulição porque as moléculas precisam de mais energia para empurrar contra essa força externa mais forte.
Inversamente, se você diminuir a pressão externa (por exemplo, indo para uma altitude elevada), você diminui o ponto de ebulição. É por isso que a água ferve a uma temperatura mais baixa em Denver do que ao nível do mar.
O Efeito da Pressão na Fusão
Para a maioria das substâncias, o aumento da pressão aumenta ligeiramente o ponto de fusão. Isso ocorre porque a pressão ajuda a manter as moléculas na estrutura rígida e compacta de um sólido.
A água é uma exceção famosa. Como o gelo sólido é menos denso que a água líquida, aplicar pressão na verdade torna mais fácil derretê-lo. É por isso que a lâmina de um patinador no gelo pode deslizar sobre o gelo.
Armadilhas Comuns e Nuances
Olhar apenas para um fator pode ser enganoso. A interação entre forças, massa e forma cria nuances importantes.
Massa Molecular vs. Força Intermolecular
Embora os pontos de ebulição geralmente aumentem com a massa molar, o tipo de FIM é muito mais dominante.
Uma molécula pequena com fortes ligações de hidrogênio, como a água (18 g/mol, ferve a $100^\circ\text{C}$), terá um ponto de ebulição vastamente maior do que uma molécula de tamanho semelhante com apenas fracas forças de dispersão, como o metano (16 g/mol, ferve a $-161,5^\circ\text{C}$).
O Impacto da Forma Molecular
Para moléculas com a mesma fórmula química (isômeros), a forma importa. Moléculas longas e retas têm mais área de superfície para contato, levando a forças de dispersão de London mais fortes e pontos de ebulição mais altos.
Moléculas compactas e esféricas têm menos área de superfície e, portanto, atrações mais fracas e pontos de ebulição mais baixos.
Fazendo a Previsão Correta
Ao combinar esses princípios, você pode avaliar com precisão por que substâncias diferentes se comportam da maneira que o fazem.
- Se seu foco principal é comparar substâncias diferentes: Primeiro, identifique a força intermolecular mais forte presente em cada uma; este será quase sempre o determinante primário de seus pontos de ebulição relativos.
- Se seu foco principal é alterar as condições de uma substância: Analise como as mudanças na pressão externa afetarão a energia necessária para uma transição de fase, especialmente para a ebulição.
- Se você encontrar um resultado inesperado: Considere fatores secundários como a forma molecular ou as propriedades de densidade únicas da substância, como visto com a água.
Ao entender esses princípios centrais, você pode passar de simplesmente memorizar pontos de fusão e ebulição para realmente compreender o comportamento físico da matéria.
Tabela de Resumo:
| Fator | Descrição | Efeito no Ponto de Fusão/Ebulição |
|---|---|---|
| Forças Intermoleculares (FIMs) | Força de atração entre as moléculas. | Forças mais fortes = Ponto mais alto |
| Ligação de Hidrogênio | Força forte com ligações H-F, H-O, H-N. | Ponto muito alto |
| Dipolo-Dipolo | Força moderada entre moléculas polares. | Ponto moderado |
| Dispersão de London | Força fraca em todas as moléculas, aumenta com o tamanho. | Ponto baixo (a menos que a molécula seja grande) |
| Pressão Externa | Pressão aplicada à substância. | Pressão mais alta = Ponto de ebulição mais alto (geralmente) |
Precisa de controle preciso da temperatura para seus processos de laboratório? Entender as transições de fase é fundamental para aplicações como síntese de materiais, purificação química e preparação de amostras. Na KINTEK, somos especializados em equipamentos de laboratório de alta qualidade, incluindo estufas, fornos e sistemas de controle de temperatura, projetados para fornecer a precisão e a confiabilidade que sua pesquisa exige. Deixe que nossos especialistas ajudem você a selecionar o equipamento perfeito para sua aplicação específica. Entre em contato conosco hoje para discutir suas necessidades de laboratório!
Guia Visual
Produtos relacionados
- Forno de Tratamento Térmico a Vácuo e Forno de Fusão por Indução de Levitação
- Sistema de Rotação por Fusão a Vácuo Forno de Fusão a Arco
- Forno de Indução a Vácuo em Escala Laboratorial
- Máquina de Prensa Hidráulica Automática Calefactada com Placas Calefactadas para Prensa Caliente de Laboratorio 25T 30T 50T
- Máquina de Prensagem Hidráulica Aquecida com Placas Aquecidas Manuais Integradas para Uso em Laboratório
As pessoas também perguntam
- Como funciona o processo de tratamento térmico? Adapte as propriedades do material para sua aplicação
- Quais são as partes de um forno a vácuo? Um guia para os 5 sistemas principais
- Quais são os diferentes tipos de processo de tratamento térmico para aço? Adapte a Resistência, Dureza e Tenacidade
- Quais são os cinco processos básicos de tratamento térmico de metais? Recozimento, Têmpera e Mais
- Qual é a diferença entre recozimento, têmpera e revenimento? Domine as Propriedades dos Metais para o Seu Laboratório






















