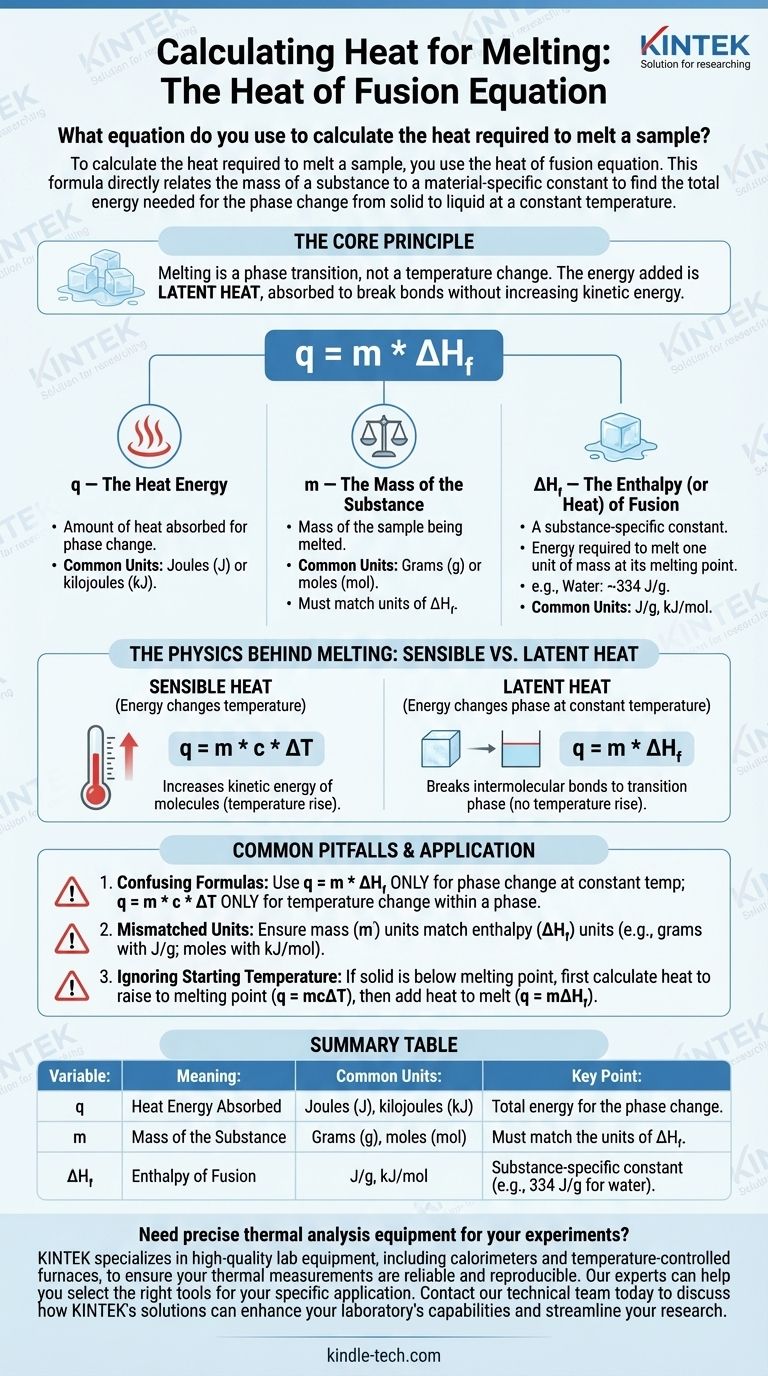
Para calcular o calor necessário para derreter uma amostra, você usa a equação do calor de fusão. Esta fórmula relaciona diretamente a massa de uma substância com uma constante específica do material para encontrar a energia total necessária para a mudança de fase de sólido para líquido a uma temperatura constante.
O princípio central é que o derretimento é uma transição de fase, não uma mudança de temperatura. A energia que você adiciona é chamada de calor latente, que é absorvido para quebrar as ligações da estrutura sólida sem aumentar a energia cinética das moléculas.

Desconstruindo a Equação do Calor de Fusão
A fórmula para calcular o calor absorvido durante o derretimento é:
q = m * ΔH_f
Cada variável nesta equação representa uma parte crítica do processo físico. Compreendê-las individualmente é fundamental para aplicar a fórmula corretamente.
q — A Energia Térmica
q representa a quantidade de calor absorvida pela substância para sofrer a mudança de fase. Este valor é tipicamente expresso em Joules (J) ou quilojoules (kJ), embora contextos mais antigos possam usar calorias (cal).
m — A Massa da Substância
m é a massa da amostra que você está derretendo. É crucial que as unidades de massa, tipicamente gramas (g) ou mols (mol), correspondam às unidades usadas na constante de calor de fusão para essa substância.
ΔH_f — A Entalpia (ou Calor) de Fusão
ΔH_f é a variável mais importante. É a entalpia de fusão, frequentemente chamada de calor latente de fusão.
Esta é uma constante física única para cada substância. Ela define a quantidade de energia necessária para derreter uma unidade de massa (por exemplo, 1 grama ou 1 mol) dessa substância em seu ponto de fusão.
Por exemplo, o calor de fusão da água é de aproximadamente 334 Joules por grama (J/g). Isso significa que você deve adicionar 334 Joules de energia para derreter 1 grama de gelo a 0°C em 1 grama de água líquida a 0°C.
A Física por Trás do Derretimento: Calor Sensível vs. Latente
Um ponto comum de confusão é por que a temperatura não aumenta durante o derretimento. Isso é explicado pela diferença entre dois tipos de energia térmica.
Calor Sensível
Calor sensível é a energia que altera a temperatura de uma substância. Quando você adiciona calor sensível, você aumenta a energia cinética das moléculas, fazendo-as mover-se mais rapidamente, o que medimos como um aumento de temperatura. A fórmula para isso é q = m * c * ΔT.
Calor Latente
Calor latente é a energia absorvida ou liberada durante uma mudança de fase a uma temperatura constante. Durante o derretimento, a energia de entrada é usada inteiramente para quebrar as ligações intermoleculares que mantêm a rede cristalina do sólido unida, fazendo a transição para um líquido.
Como a energia está "escondida" na mudança de fase em vez de causar um aumento de temperatura, ela é chamada de latente.
Armadilhas Comuns a Evitar
Aplicar o conceito ou a fórmula errada é uma fonte frequente de erro em cálculos termodinâmicos. Esteja ciente desses erros comuns.
Confundir Calor de Fusão com Calor Específico
O erro mais comum é usar a fórmula errada.
- Use
q = m * ΔH_f(Calor de Fusão) SOMENTE para uma mudança de fase a uma temperatura constante (por exemplo, derreter gelo a 0°C). - Use
q = m * c * ΔT(Calor Específico) SOMENTE para alterar a temperatura de uma substância dentro de uma única fase (por exemplo, aquecer gelo sólido de -10°C para 0°C).
Unidades Incompatíveis
Sempre verifique suas unidades. Se sua massa (m) estiver em gramas, seu calor de fusão (ΔH_f) deve estar em Joules por grama (J/g). Se ΔH_f for dado em quilojoules por mol (kJ/mol), você deve primeiro converter a massa de sua amostra para mols.
Ignorar a Temperatura Inicial
A equação do calor de fusão só se aplica se a substância já estiver em seu ponto de fusão. Se você tiver um sólido abaixo de seu ponto de fusão, você deve realizar um cálculo em duas etapas:
- Calcule o calor necessário para elevar o sólido ao seu ponto de fusão (
q = mcΔT). - Calcule o calor necessário para derreter o sólido em seu ponto de fusão (
q = mΔH_f). - Adicione os resultados para o calor total necessário.
Aplicando a Fórmula Correta para o Seu Cálculo
Para garantir que você resolva seu problema corretamente, identifique o processo exato que você precisa calcular.
- Se o seu foco principal é derreter uma substância já em seu ponto de fusão: Você só precisa da equação do calor de fusão:
q = m * ΔH_f. - Se o seu foco principal é aquecer uma substância sem mudar sua fase: Você só precisa da equação da capacidade de calor específico:
q = m * c * ΔT. - Se o seu foco principal é aquecer um sólido e depois derretê-lo completamente: Você deve calcular o calor para ambas as etapas separadamente e adicioná-las:
q_total = (m * c * ΔT)_aquecimento + (m * ΔH_f)_derretimento.
Compreender qual processo físico você está modelando é a chave para selecionar a equação certa.
Tabela Resumo:
| Variável | Significado | Unidades Comuns | Ponto Chave |
|---|---|---|---|
| q | Energia Térmica Absorvida | Joules (J), quilojoules (kJ) | Energia total para a mudança de fase |
| m | Massa da Substância | Gramas (g), mols (mol) | Deve corresponder às unidades de ΔH_f |
| ΔH_f | Entalpia de Fusão | J/g, kJ/mol | Constante específica da substância (por exemplo, 334 J/g para água) |
Precisa de equipamento de análise térmica preciso para seus experimentos?
Calcular com precisão os requisitos de calor é fundamental na ciência dos materiais, química e farmacêutica. A KINTEK é especializada em equipamentos de laboratório de alta qualidade, incluindo calorímetros e fornos com controle de temperatura, para garantir que suas medições térmicas sejam confiáveis e reproduzíveis.
Nossos especialistas podem ajudá-lo a selecionar as ferramentas certas para sua aplicação específica, seja você estudando mudanças de fase, síntese de materiais ou cinética de reação.
Entre em contato com nossa equipe técnica hoje para discutir como as soluções da KINTEK podem aprimorar as capacidades do seu laboratório e otimizar sua pesquisa.
Guia Visual
Produtos relacionados
- Máquina de Prensagem Hidráulica Aquecida com Placas Aquecidas Manuais Integradas para Uso em Laboratório
- Máquina de Prensagem Hidráulica Aquecida 24T 30T 60T com Placas Aquecidas para Prensagem a Quente de Laboratório
- Molde de Prensa Elétrica de Aquecimento para Laboratório Cilíndrico para Aplicações Laboratoriais
- Máquina de Prensa Hidráulica Automática Calefactada com Placas Calefactadas para Prensa Caliente de Laboratorio 25T 30T 50T
- Molde de Prensa Infravermelha de Laboratório
As pessoas também perguntam
- De que três maneiras podemos usar a biomassa como fonte de energia? Aproveitando a Matéria Orgânica para Geração de Energia
- Quais são os perigos dos NTCs? Compreendendo os Riscos Físicos dos Nanotubos de Carbono
- Como o tempo de depoimento é calculado? Dominando o Relógio para Vantagem Legal Estratégica
- Como converter óleo de pirólise em diesel? Um Guia para Hidrodesoxigenação (HDO)
- Quais faixas de temperatura estão tipicamente associadas a freezers de temperatura ultrabaixa? Preservar Amostras de -40°C a -86°C
- Quais são os requisitos de hardware para tratamento com AHP vs. ácido? Simplifique seu laboratório com vasos de reação de baixo custo
- Por que a Alumina é Adicionada na Cromização-Aluminização por SHS? Otimiza a Combustão e a Estabilidade do Revestimento
- Por que é necessário um fluxo contínuo de nitrogênio de alta pureza durante a pirólise catalítica de plásticos? Maximizar o Rendimento de Combustível


























