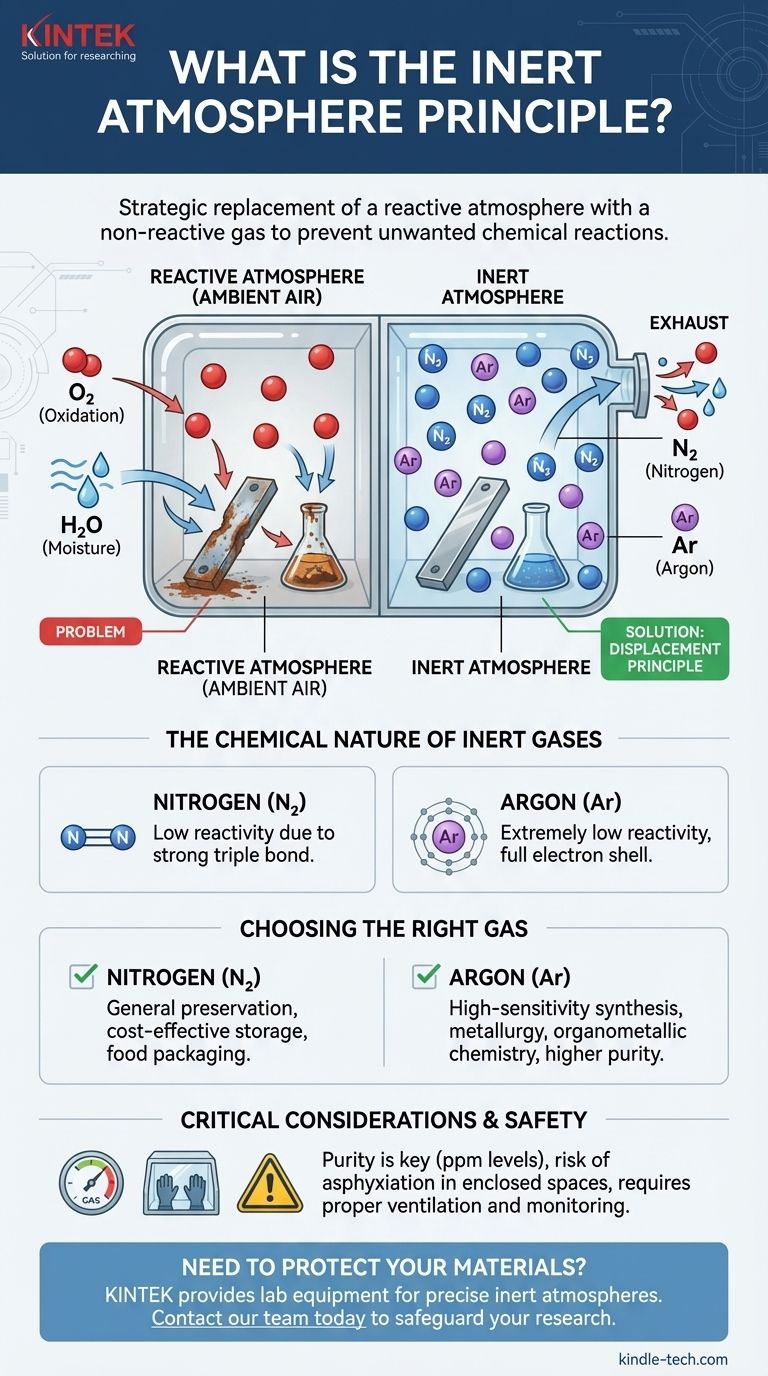
O princípio da atmosfera inerte é a substituição estratégica de uma atmosfera reativa, como o ar ambiente, por um gás não reativo (inerte). Isso é feito para criar um ambiente controlado que previne reações químicas indesejadas, como oxidação e degradação impulsionada pela humidade. Os gases inertes mais comuns usados para este fim são o nitrogénio e o árgon, que deslocam o oxigénio e o vapor de água de um sistema.
O objetivo de uma atmosfera inerte não é adicionar um ingrediente especial, mas sim remover os problemáticos. Ao deslocar sistematicamente gases reativos como o oxigénio e a água, cria-se um ambiente estável que protege materiais sensíveis e garante que os processos químicos decorram sem interferência.

O Problema: Reatividade Atmosférica Não Controlada
O ar normal, o ambiente em que existimos, é uma mistura química surpreendentemente reativa. Para muitos processos científicos e industriais, esta reatividade é um problema significativo.
Porque o Ar Normal é um Desafio
A nossa atmosfera é composta por aproximadamente 21% de oxigénio e quantidades variáveis de vapor de água. Ambos os componentes são altamente reativos e ávidos por participar em reações químicas.
O oxigénio é um poderoso agente oxidante, o que significa que aceita prontamente eletrões de outras substâncias. Esta é a causa raiz de processos comuns como a ferrugem e a combustão.
O Impacto da Oxidação e Degradação
Quando materiais sensíveis são expostos ao ar, podem degradar-se rapidamente. Por exemplo, o oxigénio pode arruinar uma delicada experiência eletroquímica ao reagir na superfície do eletrodo, obscurecendo os resultados que se tenta medir.
Da mesma forma, muitos produtos químicos avançados, produtos farmacêuticos e reagentes irão decompor-se ou perder a sua potência quando expostos ao oxigénio ou à humidade. Este princípio também explica porque os fabricantes de alimentos embalam produtos como batatas fritas em sacos cheios de nitrogénio para evitar que os óleos fiquem rançosos.
Como uma Atmosfera Inerte Resolve o Problema
Uma atmosfera inerte contraria diretamente a ameaça da reatividade atmosférica, alterando fisicamente o ambiente a nível gasoso.
O Princípio do Deslocamento
A técnica central envolve purgar um recipiente, vaso de reação ou câmara com um gás inerte. À medida que o gás inerte flui, ele empurra fisicamente, ou desloca, o ar ambiente contendo oxigénio e vapor de água.
Isso é frequentemente conseguido borbulhando o gás inerte (como árgon ou nitrogénio) através de uma solução líquida ou lavando continuamente um invólucro selado, como uma caixa de luvas.
A Natureza Química dos Gases Inertes
Gases como o nitrogénio (N₂) e o árgon (Ar) são escolhidos porque são extremamente não reativos.
O Árgon é um gás nobre, o que significa que a sua camada eletrónica mais externa está completa. Não tem incentivo químico para reagir com outros elementos.
O Gás nitrogénio é uma molécula diatómica (N₂) mantida unida por uma ligação tripla excecionalmente forte. É necessária uma quantidade significativa de energia para quebrar esta ligação, tornando o gás nitrogénio muito estável e improvável de participar na maioria das reações em condições normais.
Compreendendo as Compromissos
Embora o princípio seja simples, a sua aplicação prática envolve escolhas importantes e potenciais desafios.
Escolher o Gás Certo: Nitrogénio vs. Árgon
O Nitrogénio é o principal gás para atmosferas inertes. É muito menos dispendioso do que o árgon e é suficientemente inerte para a grande maioria das aplicações, desde embalagens de alimentos até armazenamento químico geral.
O Árgon é usado para aplicações altamente sensíveis onde mesmo a menor reatividade não pode ser tolerada. É quimicamente mais inerte do que o nitrogénio e, sendo mais denso do que o ar, pode formar um "manto" protetor mais estável sobre um processo. Isso o torna ideal para metalurgia de alta temperatura e síntese organometálica sensível.
O Desafio da Pureza
Simplesmente purgar um sistema uma vez pode não ser suficiente. Mesmo vestígios de oxigénio ou vapor de água (medidos em partes por milhão) podem ser suficientes para perturbar experiências altamente sensíveis ou degradar materiais ultra-puros.
Alcançar e manter um alto nível de pureza geralmente requer purga contínua, vedação meticulosa do sistema e, às vezes, o uso de depuradores de oxigénio para remover os últimos vestígios residuais.
Considerações Críticas de Segurança
Os gases inertes são asfixiantes simples. Não são tóxicos, mas deslocam o oxigénio necessário para a respiração. Trabalhar num espaço fechado onde um gás inerte está em uso pode ser extremamente perigoso e requer ventilação adequada e monitorização contínua do oxigénio para prevenir a asfixia.
Fazendo a Escolha Certa para o Seu Objetivo
A seleção da abordagem correta depende inteiramente do seu objetivo, orçamento e requisitos de sensibilidade.
- Se o seu foco principal é a preservação geral ou armazenamento a granel: O nitrogénio é quase sempre a escolha mais económica e prática para prevenir a oxidação.
- Se o seu foco principal é a síntese de alta sensibilidade ou eletroquímica: O árgon é a escolha superior pela sua quase total falta de reatividade, justificando o seu custo mais elevado.
- Se o seu foco principal é o processamento de metais a alta temperatura: O árgon é essencial, pois o nitrogénio pode reagir com alguns metais a altas temperaturas para formar nitretos indesejados.
Em última análise, dominar o princípio da atmosfera inerte é sobre controlar o ambiente químico para alcançar resultados previsíveis e confiáveis.
Tabela Resumo:
| Aspeto | Nitrogénio (N₂) | Árgon (Ar) |
|---|---|---|
| Uso Principal | Preservação geral, armazenamento económico | Síntese de alta sensibilidade, processos de alta temperatura |
| Reatividade | Baixa (ligação tripla forte) | Extremamente baixa (gás nobre) |
| Custo | Mais baixo | Mais alto |
| Ideal Para | Embalagens de alimentos, armazenamento de produtos químicos a granel | Metalurgia, química organometálica, eletroquímica sensível |
Precisa de proteger os seus materiais ou processos da oxidação?
Na KINTEK, somos especialistas em fornecer o equipamento de laboratório e consumíveis certos para criar e manter atmosferas inertes precisas para a sua aplicação específica. Quer necessite de uma solução económica de nitrogénio ou de um ambiente de árgon ultra-puro para trabalhos sensíveis, os nossos especialistas podem ajudá-lo a selecionar o sistema ideal.
Contacte a nossa equipa hoje para discutir como podemos salvaguardar a sua pesquisa e produção com soluções fiáveis de atmosfera inerte.
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é o propósito principal do uso de atmosferas no tratamento térmico? Proteger superfícies e melhorar a qualidade do metal
- Qual é o papel de um forno de atmosfera de alta temperatura na preparação da liga X-750? Alcançar tratamento de solução preciso
- O que é o processo de recozimento em hidrogênio? Obtenha Peças Metálicas Limpas, Fortes e Livres de Tensão
- Qual o papel do gás protetor redutor nas cerâmicas híbridas de Cu-SiOC? Garante a Condutividade via Redução Ativa
- Qual é a temperatura do recozimento por hidrogênio? Proteja seus componentes metálicos contra a fragilização
- Como os fornos de recozimento em atmosfera de alta temperatura garantem a atividade eletrocatalítica? Otimize seus nitretos metálicos
- Qual é o uso do hidrogénio em fornos? Uma Chave para o Processamento a Altas Temperaturas Livre de Oxigénio
- Qual o papel de um forno atmosférico de alta temperatura na avaliação da resistência à oxidação? Otimizar a Análise de Revestimentos



















