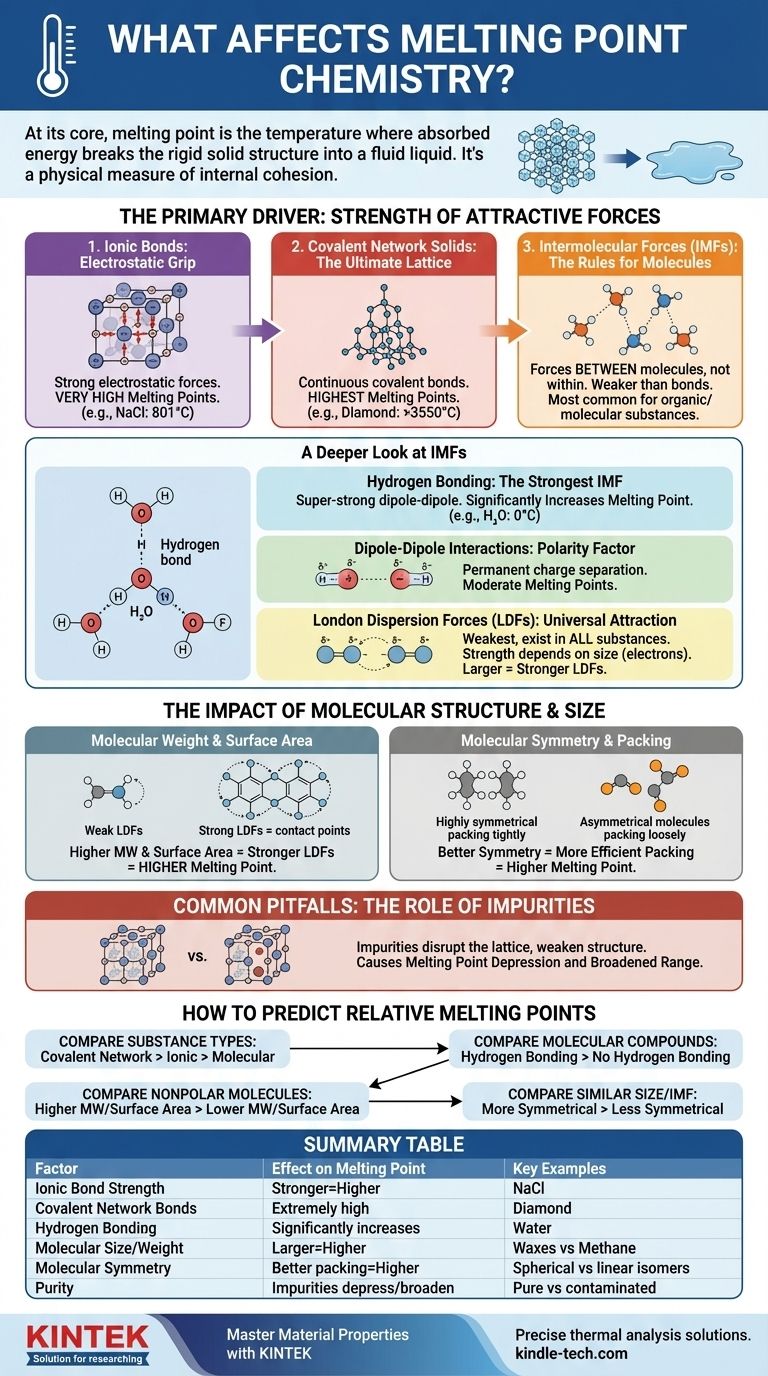
Na sua essência, o ponto de fusão de uma substância é a temperatura na qual ela absorveu energia suficiente para quebrar a estrutura rígida e ordenada de um sólido e fazer a transição para um líquido desordenado e fluido. Isso é determinado por dois fatores principais: a força das forças atrativas que mantêm as partículas (átomos, iões ou moléculas) unidas e a eficiência com que essas partículas se empacotam numa rede cristalina sólida.
O ponto de fusão não é apenas um número; é uma medida física da coesão interna de uma substância. Para o entender, deve primeiro identificar a força dominante que mantém as partículas unidas — seja uma poderosa ligação iónica ou uma fraca atração intermolecular — e depois considerar como o tamanho e a forma molecular refinam esse valor.

O Principal Impulsionador: Força das Forças Atrativas
A quantidade de energia necessária para romper uma rede sólida é diretamente proporcional à força das forças que a mantêm unida. Essas forças existem num vasto espectro, desde ligações químicas incrivelmente fortes até forças intermoleculares muito mais fracas.
Ligações Iónicas: A Aderência Eletrostática
Compostos iónicos, como o sal de mesa (NaCl), são mantidos unidos por poderosas atrações eletrostáticas entre iões positivos e negativos. Essas forças criam uma rede cristalina muito estável.
Superar essas fortes atrações requer uma tremenda quantidade de energia térmica, razão pela qual os compostos iónicos geralmente têm pontos de fusão muito altos.
Sólidos de Rede Covalente: A Rede Definitiva
Num sólido de rede covalente, como o diamante ou o quartzo (SiO₂), os átomos não são apenas atraídos uns pelos outros; eles são unidos por uma rede contínua de fortes ligações covalentes. Não há moléculas individuais para separar.
Para fundir tal substância, é preciso começar a quebrar essas poderosas ligações covalentes. Isso requer mais energia do que qualquer outro tipo de interação, dando a esses materiais os pontos de fusão mais altos de todas as substâncias.
Forças Intermoleculares (FIMs): As Regras para Moléculas
Para compostos moleculares (como água, açúcar ou cera), o ponto de fusão não se trata de quebrar as ligações covalentes dentro das moléculas. Trata-se de superar as forças de atração mais fracas entre as moléculas. Estas são conhecidas como forças intermoleculares (FIMs).
Um Olhar Mais Profundo sobre as Forças Intermoleculares (FIMs)
O tipo e a força das FIMs são o fator mais importante para determinar o ponto de fusão da maioria das substâncias orgânicas e moleculares. Elas são geralmente muito mais fracas do que as ligações químicas completas.
Ligação de Hidrogénio: A FIM Mais Forte
Este é um tipo especial e superforte de interação dipolo-dipolo que ocorre quando o hidrogénio está ligado a um átomo altamente eletronegativo como nitrogénio (N), oxigénio (O) ou flúor (F).
A atração resultante entre as moléculas é significativa. A água (H₂O) é um exemplo clássico; as suas ligações de hidrogénio dão-lhe um ponto de fusão muito mais alto (0 °C) do que seria esperado para uma molécula do seu tamanho.
Interações Dipolo-Dipolo: O Fator Polaridade
Moléculas polares têm uma separação permanente de carga, criando uma extremidade positiva e uma negativa, como pequenos ímanes. Esses "polos" moleculares atraem-se mutuamente.
Essas forças são mais fortes do que as forças entre moléculas não polares de tamanho semelhante, levando a pontos de fusão moderados.
Forças de Dispersão de London (FDLs): A Atração Universal
As FDLs são o tipo mais fraco de FIM e existem em todas as substâncias. Elas surgem das flutuações aleatórias e temporárias na distribuição eletrónica em torno de uma molécula, o que cria dipolos fugazes e instantâneos.
A força das FDLs depende diretamente do tamanho da molécula (especificamente, do seu número de eletrões). Moléculas maiores têm nuvens eletrónicas maiores e mais "instáveis", tornando-as mais polarizáveis e levando a FDLs mais fortes. É por isso que moléculas grandes e não polares como a cera ainda podem ser sólidas à temperatura ambiente.
O Impacto da Estrutura e Tamanho Molecular
Além do tipo de força, a forma e o tamanho específicos de uma molécula desempenham um papel crítico no refinamento do seu ponto de fusão.
Peso Molecular e Área de Superfície
Para moléculas com a mesma FIM dominante (por exemplo, comparando duas moléculas não polares), aquela com o maior peso molecular terá FDLs mais fortes e, portanto, um ponto de fusão mais alto. Uma maior área de superfície permite mais pontos de contacto entre as moléculas, também fortalecendo as FDLs.
Simetria e Empacotamento Molecular
A simetria tem um efeito profundo. Moléculas altamente simétricas podem empacotar-se de forma mais eficiente e compacta numa rede cristalina estável, como peças de LEGO bem feitas.
Esta disposição densa e ordenada requer mais energia para ser desfeita. Portanto, uma molécula mais simétrica terá frequentemente um ponto de fusão significativamente mais alto do que um isómero menos simétrico, mesmo que tenham a mesma fórmula e peso.
Armadilhas Comuns a Evitar: O Papel das Impurezas
Num contexto prático e real, um dos fatores mais comuns que afetam o ponto de fusão é a pureza da amostra.
Interrupção da Rede Cristalina
As impurezas são partículas estranhas que não se encaixam perfeitamente na rede cristalina da substância. Elas introduzem defeitos e enfraquecem a estrutura geral.
Como a rede já está perturbada, é preciso menos energia para a quebrar, resultando num ponto de fusão mais baixo. Este fenómeno é conhecido como depressão do ponto de fusão.
Uma Faixa de Fusão Alargada
Uma substância pura geralmente funde-se numa faixa de temperatura muito estreita (muitas vezes menos de 1 °C). A presença de impurezas não só diminui o ponto de fusão, mas também faz com que a substância se funda numa faixa de temperatura mais ampla e alargada. Os químicos usam esta característica para avaliar a pureza de um composto sintetizado.
Como Prever Pontos de Fusão Relativos
Ao comparar duas substâncias, siga esta hierarquia de perguntas para fazer uma previsão precisa.
- Se o seu foco principal é comparar diferentes tipos de substâncias: Um sólido de rede covalente (diamante) terá um ponto de fusão mais alto do que um composto iónico (sal), que será muito mais alto do que um composto molecular (açúcar).
- Se o seu foco principal é comparar dois compostos moleculares: Primeiro, verifique a ligação de hidrogénio. A molécula que pode formar ligações de hidrogénio quase sempre terá um ponto de fusão mais alto do que uma que não pode, assumindo tamanho semelhante.
- Se o seu foco principal é comparar duas moléculas não polares: A molécula com o maior peso molecular e maior área de superfície terá Forças de Dispersão de London mais fortes e um ponto de fusão mais alto.
- Se o seu foco principal é comparar duas moléculas de tamanho e tipo de FIM semelhantes: A molécula mais simétrica que pode empacotar-se de forma mais eficiente numa rede cristalina provavelmente terá o ponto de fusão mais alto.
Compreender esses fatores transforma o ponto de fusão de um simples dado num poderoso indicador das forças e estrutura moleculares fundamentais de uma substância.
Tabela Resumo:
| Fator | Efeito no Ponto de Fusão | Exemplos Chave |
|---|---|---|
| Força da Ligação Iónica | Ligações mais fortes = Ponto de fusão mais alto | Cloreto de Sódio (NaCl): 801°C |
| Ligações de Rede Covalente | Pontos de fusão extremamente altos | Diamante: >3550°C |
| Ligação de Hidrogénio | Aumenta significativamente o ponto de fusão | Água (H₂O): 0°C |
| Tamanho/Peso Molecular | Moléculas maiores = Ponto de fusão mais alto (FDLs mais fortes) | Ceras (alto PM) vs. Metano (baixo PM) |
| Simetria Molecular | Melhor empacotamento = Ponto de fusão mais alto | Isómeros esféricos vs. lineares |
| Pureza | Impurezas deprimem e alargam a faixa de fusão | Amostras puras vs. contaminadas |
Domine as Propriedades dos Materiais com a KINTEK
Compreender os pontos de fusão é crucial para a seleção de materiais, síntese e controlo de qualidade no laboratório. Quer esteja a desenvolver novos compostos ou a analisar a pureza de materiais, ter o equipamento certo é essencial.
A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, concebidos para fornecer análises térmicas precisas e fiáveis. Os nossos produtos ajudam investigadores e profissionais de laboratório a determinar com precisão os pontos de fusão e a compreender o comportamento dos materiais.
Pronto para melhorar as capacidades do seu laboratório? Contacte os nossos especialistas hoje para encontrar a solução perfeita para as suas necessidades de análise térmica.
Guia Visual
Produtos relacionados
- Forno de Tratamento Térmico a Vácuo e Forno de Fusão por Indução de Levitação
- Forno de Indução a Vácuo em Escala Laboratorial
- Sistema de Rotação por Fusão a Vácuo Forno de Fusão a Arco
- Máquina de Prensagem Hidráulica Aquecida com Placas Aquecidas Manuais Integradas para Uso em Laboratório
- Fornalha de Fusão por Arco a Vácuo Não Consumível
As pessoas também perguntam
- Quais são as partes de um forno a vácuo? Um guia para os 5 sistemas principais
- Quais são os quatro tipos de processos de tratamento térmico? Recozimento Mestre, Normalização, Cementação (Endurecimento) e Revenimento
- Quais são os diferentes tipos de processo de tratamento térmico para aço? Adapte a Resistência, Dureza e Tenacidade
- Quais são os cinco processos básicos de tratamento térmico de metais? Recozimento, Têmpera e Mais
- Qual é o processo de têmpera a vácuo? Alcance Dureza Superior com um Acabamento de Superfície Impecável





















