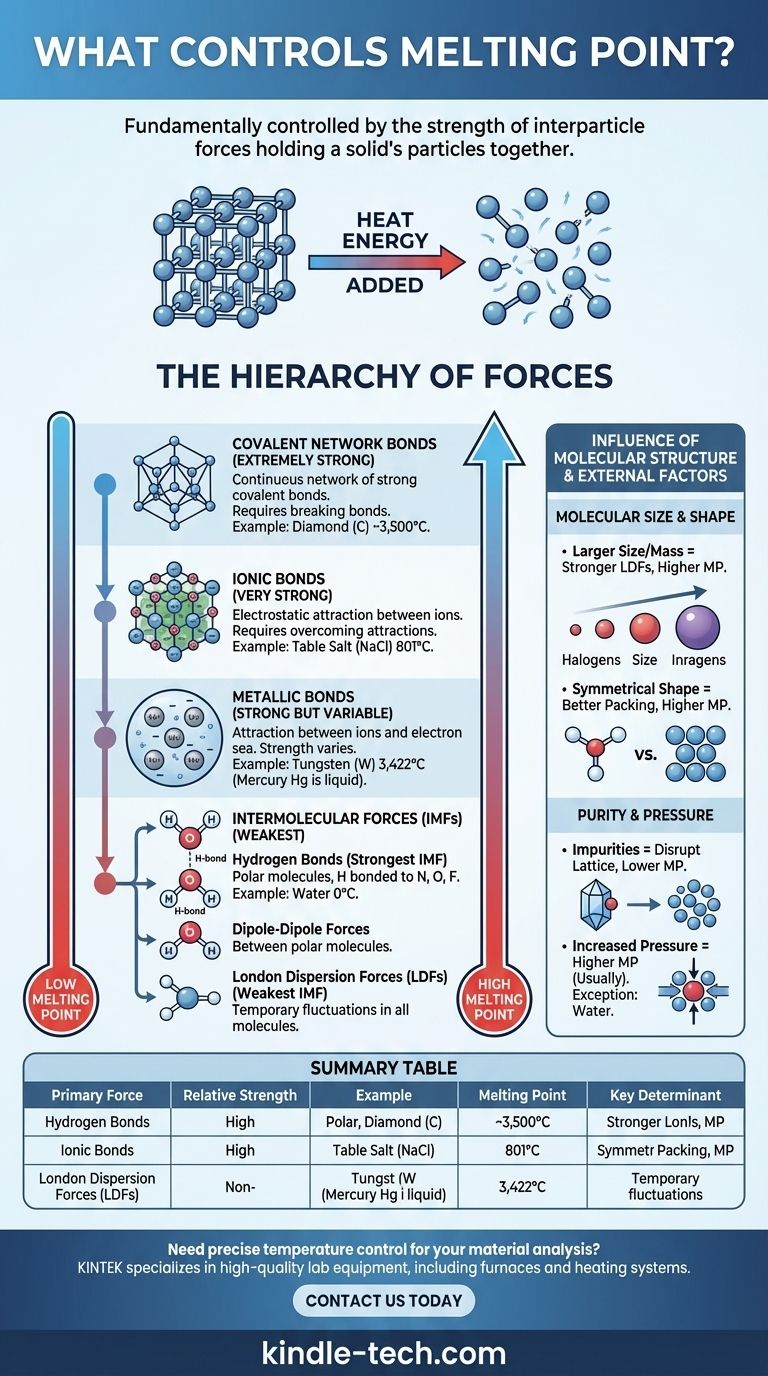
O ponto de fusão de uma substância é fundamentalmente controlado pela força das forças que mantêm as suas partículas unidas. Num sólido, as partículas (átomos, iões ou moléculas) estão presas numa disposição fixa e ordenada, chamada rede cristalina. Para derreter o sólido, é preciso adicionar energia térmica suficiente para permitir que essas partículas superem essas forças e se movam umas pelas outras como um líquido. Portanto, forças mais fortes exigem mais energia para serem quebradas, resultando num ponto de fusão mais alto.
O princípio central é simples: a fusão não se trata de quebrar as próprias partículas, mas de superar as forças atrativas entre elas. O tipo e a força dessas forças interparticulares — que variam desde poderosas ligações iónicas até fracas atrações intermoleculares — são os principais determinantes do ponto de fusão de uma substância.

A Hierarquia de Forças
A imensa variação nos pontos de fusão — dos -259°C do hidrogénio aos 3.422°C do tungsténio — pode ser compreendida classificando as forças que mantêm um sólido unido. Essas forças existem numa clara hierarquia de força.
Ligações Iónicas (Muito Fortes)
Em compostos iónicos como o sal de mesa (NaCl), as partículas são iões carregados positiva e negativamente. Eles são mantidos unidos por poderosas atrações eletrostáticas numa rede cristalina rígida.
Superar essas fortes ligações iónicas requer uma tremenda quantidade de energia térmica. Consequentemente, os compostos iónicos exibem consistentemente pontos de fusão muito altos.
Ligações de Rede Covalente (Extremamente Fortes)
Em sólidos de rede covalente, os átomos são unidos por uma vasta e contínua rede de fortes ligações covalentes. Não existem moléculas individuais; o cristal inteiro é essencialmente uma molécula gigante.
Substâncias como o diamante (carbono) e o quartzo (dióxido de silício) são exemplos primordiais. Para derretê-los, é preciso quebrar essas ligações covalentes extremamente fortes, o que exige enormes quantidades de energia, levando a pontos de fusão excecionalmente altos.
Ligações Metálicas (Fortes, mas Variáveis)
Os metais consistem numa rede de iões metálicos positivos imersos num "mar" de eletrões deslocalizados que se movem livremente por toda a estrutura. A atração entre os iões positivos e este mar de eletrões constitui a ligação metálica.
A força desta ligação, e, portanto, o ponto de fusão, varia amplamente. Depende de fatores como a carga do ião e o número de eletrões deslocalizados. É por isso que o mercúrio é um líquido à temperatura ambiente, enquanto o tungsténio tem um dos pontos de fusão mais altos de qualquer elemento.
Forças Intermoleculares (Mais Fracas)
Para compostos moleculares (como água, açúcar ou cera), as forças que devem ser superadas para a fusão são as forças intermoleculares (IMFs) — as atrações entre moléculas separadas. Estas são significativamente mais fracas do que as ligações iónicas, covalentes ou metálicas discutidas acima.
Existem três tipos principais de IMFs:
- Ligações de Hidrogénio: O tipo mais forte de IMF. Ocorre em moléculas polares onde o hidrogénio está ligado diretamente a um átomo altamente eletronegativo (nitrogénio, oxigénio ou flúor). O ponto de fusão relativamente alto da água (0°C) deve-se a estas fortes ligações de hidrogénio.
- Forças Dipolo-Dipolo: Ocorrem entre moléculas polares que possuem extremidades positivas e negativas permanentes. Estas forças são mais fracas do que as ligações de hidrogénio.
- Forças de Dispersão de London (LDFs): A IMF mais fraca, presente em todas as moléculas. Elas surgem de flutuações temporárias e aleatórias na distribuição eletrónica. Embora fracas individualmente, o seu efeito cumulativo pode ser significativo em moléculas maiores.
A Influência da Estrutura Molecular
Além do tipo de força, o tamanho e a forma específicos das partículas desempenham um papel crítico, especialmente para compostos moleculares.
Tamanho e Massa Molecular
Para compostos com a mesma força intermolecular primária (por exemplo, LDFs), moléculas maiores têm pontos de fusão mais altos. Isso ocorre porque moléculas maiores têm mais eletrões, criando uma nuvem eletrónica mais "polarizável" que leva a forças de dispersão de London mais fortes.
Essa tendência é clara nos halogéneos: o ponto de fusão aumenta à medida que se passa do flúor (F₂) para o iodo (I₂).
Forma Molecular e Eficiência de Empacotamento
A capacidade de uma molécula de se empacotar de forma compacta e eficiente numa rede cristalina tem um grande impacto. Moléculas simétricas geralmente têm pontos de fusão mais altos do que isómeros menos simétricos, mesmo que tenham a mesma fórmula e massa.
As formas simétricas permitem que as moléculas se encaixem mais de perto no estado sólido, maximizando a eficácia das suas forças intermoleculares. Quebrar essa estrutura bem organizada requer mais energia.
Compreendendo as Compensações e Nuances
A previsão de pontos de fusão envolve ponderar esses fatores interligados.
A Pureza Muda Tudo
Os princípios acima assumem uma substância pura. As impurezas perturbam a rede cristalina ordenada, enfraquecendo a estrutura geral.
Essa perturbação torna o sólido mais fácil de derreter. Como resultado, uma substância impura derreterá a uma temperatura mais baixa e numa faixa mais ampla do que a sua contraparte pura. Esse fenómeno é conhecido como depressão do ponto de fusão.
A Pressão Desempenha um Papel
Os pontos de fusão são geralmente indicados à pressão atmosférica padrão. Para a maioria das substâncias, o aumento da pressão eleva o ponto de fusão porque empurra fisicamente as partículas para mais perto, reforçando a estrutura da rede.
A água é uma exceção famosa e crítica. Como o gelo sólido é menos denso que a água líquida, o aumento da pressão favorece a fase líquida mais densa, diminuindo assim o ponto de fusão.
Como Aplicar Isto à Sua Análise
Ao comparar substâncias, use uma abordagem sistemática para identificar os principais fatores em jogo.
- Se o seu foco principal é comparar diferentes classes de sólidos: Primeiro, identifique a força de ligação primária — iónica, rede covalente, metálica ou intermolecular. Isso lhe dará o indicador mais significativo do ponto de fusão relativo.
- Se o seu foco principal é comparar dois compostos moleculares: Determine a força intermolecular mais forte que cada um possui (ligações de hidrogénio > dipolo-dipolo > LDFs). O composto com a IMF mais forte geralmente terá um ponto de fusão mais alto.
- Se o seu foco principal é em moléculas não polares semelhantes: A molécula com maior massa e área de superfície terá forças de dispersão de London mais fortes e, portanto, um ponto de fusão mais alto.
- Se o seu foco principal é em isómeros (mesma fórmula, forma diferente): A molécula mais simétrica que pode empacotar mais eficientemente numa rede cristalina geralmente terá um ponto de fusão mais alto.
Ao compreender esta hierarquia de forças e a influência da estrutura, pode explicar sistematicamente o comportamento de fusão de quase qualquer substância.
Tabela Resumo:
| Tipo de Força Primária | Força Relativa | Exemplo de Substância | Ponto de Fusão | Determinante Chave |
|---|---|---|---|---|
| Rede Covalente | Extremamente Forte | Diamante (C) | ~3.500°C | Quebra de ligações covalentes numa rede contínua |
| Ligações Iónicas | Muito Forte | Cloreto de Sódio (NaCl) | 801°C | Superando atrações eletrostáticas entre iões |
| Ligações Metálicas | Forte (Variável) | Tungsténio (W) | 3.422°C | Força da atração ião-mar de eletrões |
| Forças Intermoleculares | Mais Fraca | Água (H₂O) | 0°C | Ligações de hidrogénio, dipolo-dipolo, forças de dispersão de London |
Precisa de controlo preciso de temperatura para a sua análise de materiais? Compreender os pontos de fusão é crítico para resultados laboratoriais fiáveis. Na KINTEK, somos especializados em equipamentos de laboratório de alta qualidade, incluindo fornos e sistemas de aquecimento projetados para análise térmica precisa. Quer esteja a trabalhar com metais de alto ponto de fusão ou compostos moleculares sensíveis, as nossas soluções garantem um desempenho consistente. Contacte-nos hoje para discutir como os nossos produtos podem melhorar as capacidades do seu laboratório e apoiar a sua pesquisa. Entre em contacto através do nosso formulário de contacto para começar!
Guia Visual
Produtos relacionados
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de 1800℃ para Laboratório
- Forno Muffle de 1400℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Qual é o procedimento de análise por XRF? Um Guia para Análise Elementar Precisa
- O que é revestimento eletrônico? Um Guia para E-coating de Alto Desempenho e Processos de Acabamento
- Quais propriedades essenciais são necessárias em um bom refratário? Alcance Desempenho e Eficiência Ótimos
- Qual o papel dos agitadores termostáticos e frascos de Erlenmeyer na bioconversão? Otimize seu processo de xilose para xilitol
- O destilado de THC pode ser vaporizado? O Guia Definitivo para Vaporizar Concentrados Potentes
- Qual é o padrão para calibração de ponto de fusão? Garanta a precisão com Materiais de Referência Certificados
- Quais são 2 exemplos de deposição em química? Do Gelo Seco à Fuligem Explicado
- Como a homogeneização ultrassônica afeta as zeólitas derivadas de cinzas volantes de carvão? Melhore a estrutura do seu material hoje



















