Na espectroscopia de infravermelho (IV), a concentração governa diretamente a intensidade das bandas de absorção. Uma maior concentração de um analito na amostra resulta em uma maior absorção da radiação IV em suas frequências características. Isso faz com que os picos correspondentes no espectro de IV fiquem mais altos e proeminentes, uma relação descrita matematicamente pela Lei de Beer-Lambert.
A relação entre concentração e absorvância no IV é poderosa para a análise quantitativa, mas não é perfeitamente linear em todas as situações. Entender suas limitações práticas, como a saturação do detector em altas concentrações e os efeitos intermoleculares, é crucial para a interpretação espectral e medição precisas.
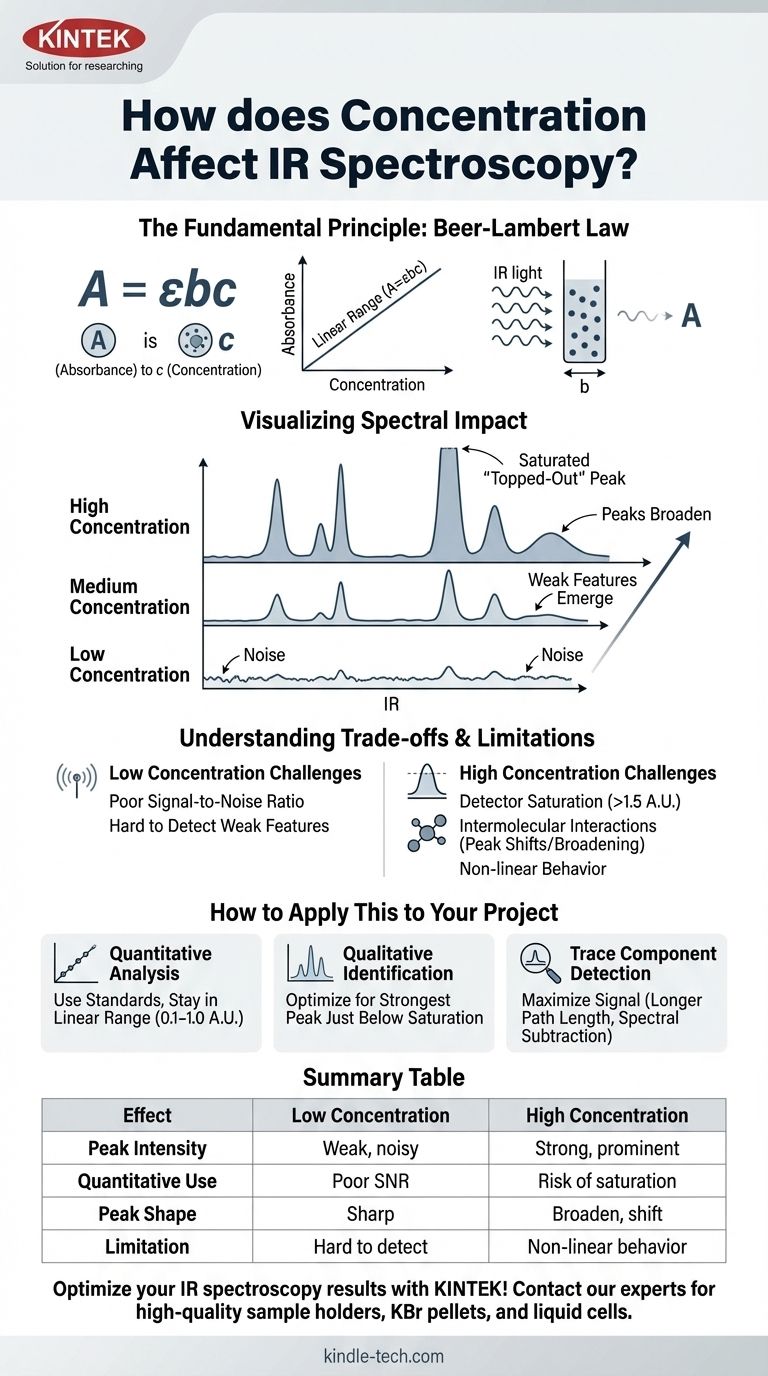
O Princípio Fundamental: A Lei de Beer-Lambert
A conexão entre concentração e absorvância é a pedra angular da espectroscopia quantitativa. Ela fornece um modelo previsível de como a luz interage com a matéria.
Definindo a Equação (A = εbc)
A Lei de Beer-Lambert é expressa como A = εbc.
- A é a Absorvância (adimensional).
- ε (epsilon) é a absorvidade molar, uma propriedade intrínseca da molécula em um comprimento de onda específico.
- b é o caminho óptico do suporte da amostra (por exemplo, a espessura de uma célula de líquido), geralmente em cm.
- c é a concentração do analito.
Esta equação mostra que a absorvância é diretamente proporcional à concentração quando o caminho óptico e a absorvidade molar são constantes.
Absorvância vs. Transmitância
Os instrumentos de IV medem fisicamente a Transmitância (%T), que é a fração de luz que passa pela amostra. No entanto, os analistas quase sempre trabalham com a Absorvância (A).
As duas estão relacionadas pela fórmula A = -log(T). A plotagem da absorvância em função da concentração resulta em uma linha reta, que é muito mais útil para a análise do que a curva exponencial produzida pela transmitância.
Visualizando o Impacto Espectral
À medida que você aumenta a concentração de uma substância:
- Os picos crescem: Os valores de absorvância de todos os picos aumentam.
- Características fracas emergem: Picos pequenos que foram perdidos no ruído da linha de base em baixas concentrações tornam-se visíveis.
- Picos fortes se alargam: Bandas de absorção muito intensas não apenas ficam mais altas, mas também mais largas.
Entendendo as Compensações e Limitações
A Lei de Beer-Lambert descreve um cenário ideal. Na prática, vários fatores podem causar desvios dessa relação linear, especialmente em altas concentrações.
O Problema dos Picos "Saturados"
Quando a concentração é muito alta, um pico pode se tornar tão intenso que absorve quase toda a luz naquela frequência. A absorvância pode exceder a faixa ideal do detector (geralmente > 1,5 UA).
Isso faz com que o pico apareça achatado ou "cortado no topo". Toda a informação quantitativa nesse pico saturado é perdida, pois o instrumento não consegue mais medir com precisão a absorvância real.
Interações Intermoleculares
Em altas concentrações, as moléculas ficam mais próximas e podem interagir umas com as outras. Um exemplo clássico é a ligação de hidrogênio em álcoois ou ácidos carboxílicos.
Essas interações podem alterar a energia vibracional das ligações, fazendo com que os picos mudem de posição, alterem a forma ou se alarguem. Isso altera a absorvidade molar (ε), quebrando a relação linear simples entre absorvância e concentração.
Efeitos Instrumentais
Nenhum instrumento é perfeito. Uma pequena quantidade de luz espúria pode atingir o detector sem passar pela amostra. Isso faz com que as leituras de absorvância atinjam um platô em altas concentrações, levando a uma curva que se dobra em direção ao eixo x em vez de permanecer linear.
O Desafio das Baixas Concentrações
Inversamente, se uma amostra estiver muito diluída, a absorvância pode ser muito baixa para ser distinguida do ruído de linha de base instrumental. A baixa relação sinal-ruído torna tanto a identificação qualitativa quanto a medição quantitativa não confiáveis.
Como Aplicar Isso ao Seu Projeto
Sua abordagem à concentração da amostra depende inteiramente do seu objetivo analítico. Você deve preparar sua amostra de forma a otimizar o espectro para sua finalidade específica.
- Se o seu foco principal for a análise quantitativa: Prepare uma série de padrões e crie uma curva de calibração, garantindo que a absorvância da sua amostra desconhecida esteja dentro da faixa linear da sua curva (geralmente 0,1–1,0 UA).
- Se o seu foco principal for a identificação qualitativa: Ajuste a preparação da sua amostra (por exemplo, quantidade em uma pastilha de KBr, caminho óptico de uma célula de líquido) para obter um espectro onde o pico mais forte esteja ligeiramente abaixo da saturação, garantindo que as bandas de grupos funcionais mais fracas estejam claramente visíveis.
- Se o seu foco principal for a detecção de um componente traço: Use técnicas que maximizem o sinal do analito, como empregar células de caminho óptico mais longas ou realizar subtração espectral para remover a interferência de um solvente ou matriz.
Em última análise, controlar e entender a concentração é a chave para transformar um espectro de IV de uma simples impressão digital em uma ferramenta analítica precisa.
Tabela de Resumo:
| Efeito da Concentração | Baixa Concentração | Alta Concentração |
|---|---|---|
| Intensidade do Pico | Picos fracos e ruidosos | Picos fortes e proeminentes |
| Uso Quantitativo | Baixa relação sinal-ruído | Risco de saturação do detector |
| Forma do Pico | Nítido, bem definido | Pode alargar e deslocar |
| Limitação Principal | Difícil de detectar | Comportamento não linear da Lei de Beer-Lambert |
Otimize seus resultados de espectroscopia de IV com a KINTEK!
Se você está realizando análise quantitativa precisa ou precisa de identificação qualitativa confiável, a preparação adequada da amostra é fundamental. A KINTEK é especializada em consumíveis e equipamentos de laboratório de alta qualidade, incluindo suportes de amostras de IV, pastilhas de KBr e células de líquido projetadas para ajudá-lo a obter a concentração e o caminho óptico ideais para espectros claros e precisos.
Entre em contato com nossos especialistas hoje mesmo para discutir suas necessidades específicas de laboratório e descobrir como nossas soluções podem aprimorar seu fluxo de trabalho de espectroscopia e a confiabilidade dos dados.
Guia Visual
Produtos relacionados
- Dióxido de Irídio IrO2 para Eletrólise de Água
- Lente de Silício Monocristalino de Alta Resistência ao Infravermelho
- Forno de Grafitação Experimental IGBT a Vácuo de Grafite
- Substrato de Safira para Revestimento de Transmissão Infravermelha
- Substrato de Vidro de Janela Óptica Folhas de Sulfeto de Zinco ZnS
As pessoas também perguntam
- O que é a sinterização de partículas metálicas? Um Guia para a Ligação em Estado Sólido de Materiais de Alta Temperatura
- Qual é o princípio da evaporação a vácuo? Desbloqueie revestimento e purificação precisos
- Quais são os perigos no tratamento térmico? Mitigando Riscos Térmicos, Químicos e Mecânicos
- Por que um processo adicional de recozimento é necessário após a silicificação? Garanta a Estabilidade e Durabilidade do Compósito
- Quais condições críticas de reação um incubador com agitação fornece? Otimizar a Hidrólise Enzimática da Celulose de Mandioca
- A sinterização é precisa? Domine as variáveis para precisão dimensional na fabricação
- Como calcular a capacidade de um filtro prensa? Use Testes Piloto para Dimensionamento Preciso
- Quais são os requisitos de calor para a brasagem? Domine a Temperatura, Tempo e Atmosfera para Juntas Fortes
















