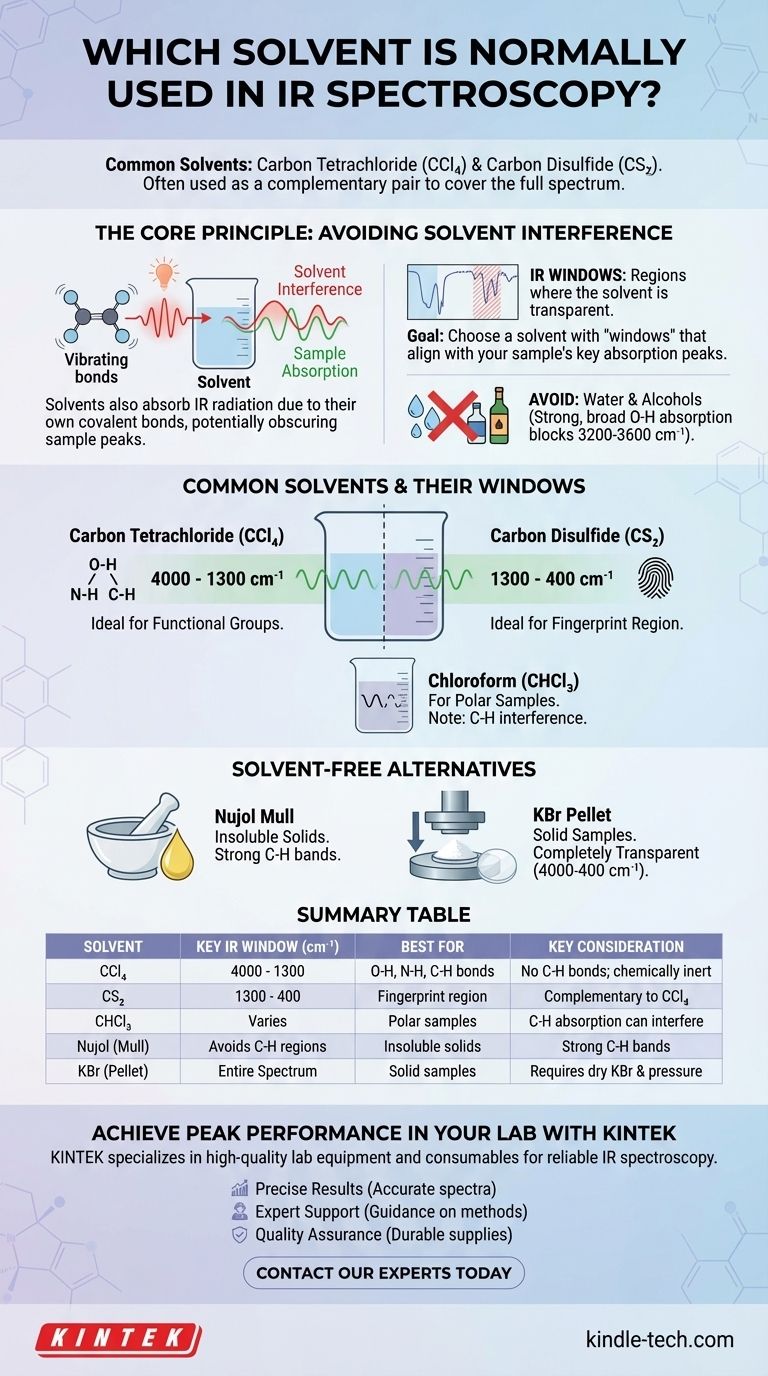
Os solventes mais comuns para espectroscopia de IV são tetracloreto de carbono (CCl₄) e dissulfeto de carbono (CS₂). Como nenhum solvente único é transparente em todo o espectro infravermelho, estes dois são frequentemente usados como um par complementar para analisar diferentes regiões. A escolha do solvente é crítica, pois o objetivo é dissolver a amostra sem que as próprias vibrações moleculares do solvente obscureçam as bandas de absorção da amostra.
O princípio fundamental da seleção de solventes em espectroscopia de IV é encontrar um meio que dissolva seu composto, mas que seja "invisível" na região espectral de seu interesse. Como não existe um solvente perfeito, o processo envolve a escolha estratégica de um solvente com "janelas de IV" transparentes conhecidas que se alinham com os principais picos de absorção de sua amostra.

O Princípio Central: Evitar a Interferência do Solvente
A espectroscopia de infravermelho funciona medindo as vibrações das ligações moleculares. O desafio é que as ligações covalentes dentro de qualquer molécula de solvente também absorverão a radiação IV, criando seus próprios picos espectrais que podem interferir ou mascarar completamente os picos de sua amostra.
Por Que os Solventes Absorvem Radiação IV
Assim como sua amostra, as moléculas de solvente são feitas de átomos conectados por ligações covalentes. Essas ligações (como C-H, C-Cl, C=S) esticam e dobram em frequências específicas quando absorvem luz infravermelha. Essa absorção é a fonte de interferência.
O Conceito de "Janelas de IV"
Nenhum solvente é transparente em toda a faixa do infravermelho médio (4000 – 400 cm⁻¹). No entanto, todo solvente possui regiões onde absorve apenas fracamente ou não absorve. Essas áreas são chamadas de "janelas de IV".
O objetivo é escolher um solvente cujas janelas correspondam às regiões de absorção dos grupos funcionais que você deseja estudar em sua amostra.
O Problema da Água e dos Álcoois
Solventes com grupos -OH, como água e etanol, quase nunca são usados para IV. A ligação O-H produz uma banda de absorção intensamente forte e ampla que obscurece completamente uma vasta e importante região do espectro (aproximadamente 3200-3600 cm⁻¹), tornando impossível ver quaisquer picos da amostra nessa área.
Solventes Comuns e Suas Janelas
Para obter um espectro completo, os químicos frequentemente realizam duas varreduras da mesma amostra: uma em um solvente que é claro na região de alta frequência e outra em um solvente que é claro na região de "impressão digital" de baixa frequência.
Tetracloreto de Carbono (CCl₄)
Esta é a escolha padrão para a região de 4000 cm⁻¹ a 1300 cm⁻¹. Por não possuir ligações C-H, é transparente onde ocorrem as vibrações de estiramento C-H, N-H e O-H, tornando-o ideal para analisar esses grupos funcionais críticos.
Dissulfeto de Carbono (CS₂)
Este é o solvente complementar ao CCl₄. É amplamente transparente na região de impressão digital de 1300 cm⁻¹ a 400 cm⁻¹. Isso permite uma análise detalhada das vibrações complexas que conferem a uma molécula sua identidade espectral única.
Clorofórmio (CHCl₃)
O clorofórmio é um solvente mais polar e pode ser uma boa escolha se sua amostra não se dissolver em CCl₄ ou CS₂. No entanto, sua própria ligação C-H cria bandas de absorção (em torno de 3000 cm⁻¹ e 1200 cm⁻¹) que podem interferir na análise das ligações C-H na amostra.
Compreendendo as Vantagens e Alternativas
A escolha de um solvente é apenas uma maneira de preparar uma amostra. Se seu composto for insolúvel ou se a interferência do solvente for inevitável, existem outras técnicas padrão.
A Inércia Química é Inegociável
Como o material de referência observa, o solvente não deve reagir com sua amostra. Usar um solvente ácido para uma amostra básica, por exemplo, resultaria em um par iônico, e você estaria analisando o espectro de uma espécie química completamente diferente da que pretendia.
A Pasta de Nujol: Uma Alternativa Sem Solvente
Quando uma amostra é insolúvel em todos os solventes de IV adequados, uma pasta de Nujol é a técnica preferida. A amostra sólida é moída em um pó fino e misturada com uma gota de Nujol (um óleo mineral) para formar uma pasta.
Esta pasta é então prensada entre duas placas de sal para análise. O próprio Nujol consiste em hidrocarbonetos de cadeia longa, então mostrará fortes bandas de absorção C-H, mas é transparente em outros lugares, permitindo a análise da maioria dos outros grupos funcionais.
A Pastilha de KBr
Outro método comum sem solvente é a pastilha de KBr. A amostra sólida é misturada com pó de brometo de potássio (KBr) puro e seco e prensada sob alta pressão para formar um pequeno disco transparente. O KBr é ligado ionicamente e não absorve radiação IV, tornando-o um meio completamente transparente para análise.
Fazendo a Escolha Certa para Sua Análise
Sua escolha do método de preparação da amostra depende inteiramente das propriedades físicas de sua amostra e das informações específicas que você precisa do espectro.
- Se seu foco principal for em ligações O-H, N-H ou C-H (4000-1300 cm⁻¹): Use tetracloreto de carbono (CCl₄) por sua excelente transparência nesta região.
- Se seu foco principal for na região de impressão digital (1300-400 cm⁻¹): Use dissulfeto de carbono (CS₂) para ter uma visão clara das vibrações complexas exclusivas de sua molécula.
- Se sua amostra for insolúvel em solventes não polares: Considere uma opção mais polar como o clorofórmio, ou ignore completamente os solventes líquidos e prepare uma pastilha de KBr ou uma pasta de Nujol.
Em última análise, a preparação eficaz da amostra garante que o espectro que você registra seja o de seu composto, e não um artefato do meio escolhido.
Tabela Resumo:
| Solvente | Janela IV Principal (cm⁻¹) | Melhor Para | Consideração Chave |
|---|---|---|---|
| Tetracloreto de Carbono (CCl₄) | 4000 - 1300 | Ligações O-H, N-H, C-H | Sem ligações C-H; quimicamente inerte |
| Dissulfeto de Carbono (CS₂) | 1300 - 400 | Região de impressão digital | Complementar ao CCl₄ |
| Clorofórmio (CHCl₃) | Varia (ex: lacunas em torno de 3000 cm⁻¹) | Amostras polares | A absorção de C-H pode interferir |
| Nujol (Pasta) | Evita regiões C-H | Sólidos insolúveis | Fortes bandas C-H do Nujol |
| KBr (Pastilha) | Espectro completo (4000-400) | Amostras sólidas | Requer KBr seco e alta pressão |
Alcance o Desempenho Máximo em Seu Laboratório
Navegar pela seleção de solventes é apenas um passo para uma análise precisa de materiais. A KINTEK é especializada em fornecer equipamentos e consumíveis de laboratório de alta qualidade que você precisa para espectroscopia de IV confiável e além.
Deixe-nos ajudá-lo a aprimorar as capacidades do seu laboratório:
- Resultados Precisos: Garanta que a preparação de sua amostra leve a espectros precisos e sem interferências.
- Suporte Especializado: Obtenha orientação sobre as ferramentas e métodos certos para sua aplicação específica.
- Garantia de Qualidade: Confie em nossos suprimentos duráveis e confiáveis para um desempenho consistente.
Pronto para otimizar seus processos analíticos? Entre em contato com nossos especialistas hoje para discutir como a KINTEK pode apoiar as necessidades exclusivas de seu laboratório em espectroscopia e análise de materiais.
Guia Visual
Produtos relacionados
- Crisol de Evaporação para Matéria Orgânica
- Dióxido de Irídio IrO2 para Eletrólise de Água
- Reator Autoclave de Laboratório de Alta Pressão para Síntese Hidrotermal
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Eletrodo de Referência Calomelano Cloreto de Prata Sulfato de Mercúrio para Uso Laboratorial
As pessoas também perguntam
- A que temperatura ocorre a evaporação? Desvende os Segredos para Controlar a Taxa de Evaporação
- Que precauções devem ser tomadas num laboratório de química? Domine o Estrutura RAMP para Segurança Máxima
- Quais são os 5 fatores que afetam a taxa de evaporação? Domine o Processo para o Seu Laboratório
- Quais são as análises utilizadas em laboratório? Escolha a Ferramenta Certa para as Necessidades do Seu Laboratório
- Como a energia é convertida em biomassa? Aproveitando o poder solar da natureza para energia renovável





