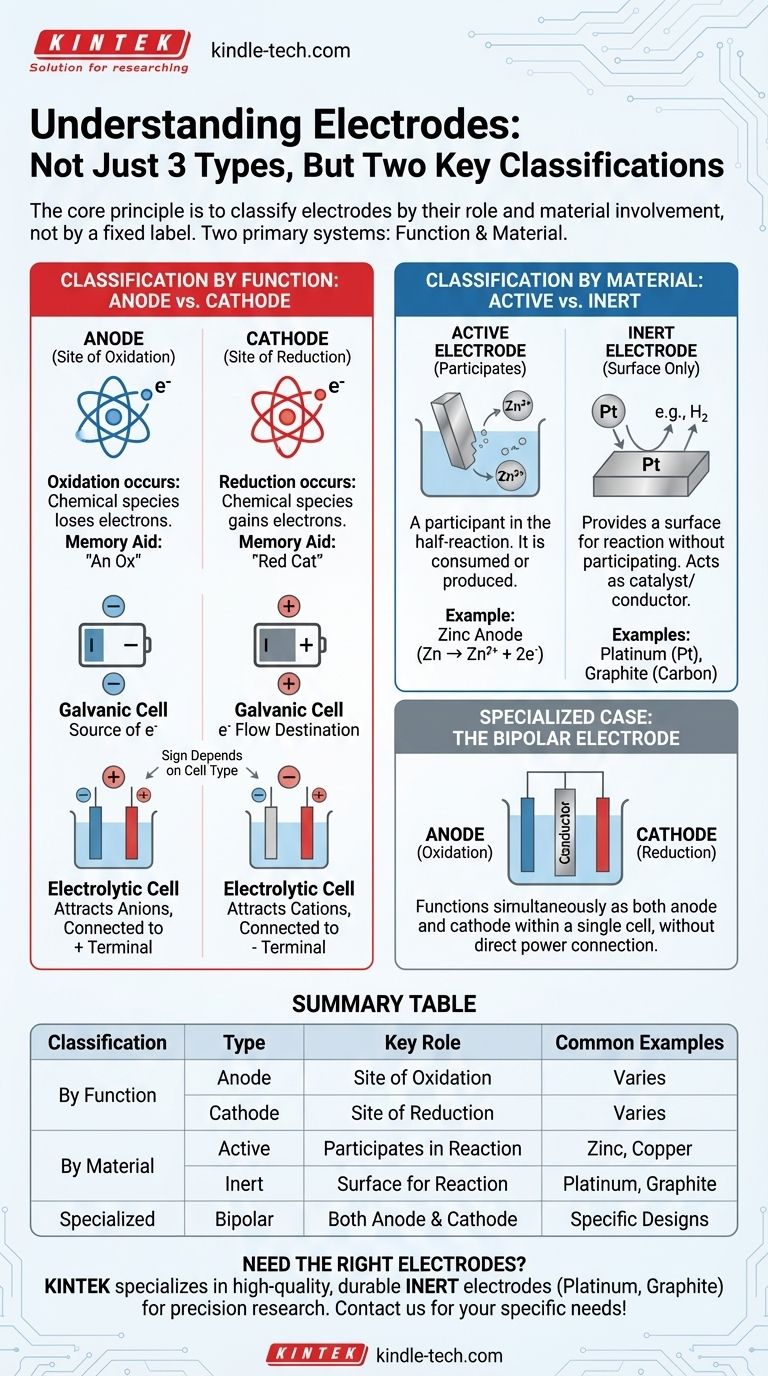
Em eletroquímica, os eletrodos são melhor compreendidos não como três tipos distintos, mas através de dois sistemas de classificação primários. O sistema mais fundamental define um eletrodo pela sua função: ou um ânodo, onde ocorre a oxidação, ou um cátodo, onde ocorre a redução. Um segundo sistema, igualmente importante, classifica-os pela sua composição material e papel na reação: ou ativos (participando na reação) ou inertes (fornecendo uma superfície para a reação).
O princípio central é classificar os eletrodos pelo seu papel, e não por um rótulo fixo. As duas classificações mais críticas baseiam-se na função (Ânodo vs. Cátodo) e no envolvimento do material (Ativo vs. Inerte). Compreender estes dois pares é a chave para analisar qualquer célula eletroquímica.

Classificação por Função: Ânodo vs. Cátodo
A forma mais fundamental de definir um eletrodo é pelo processo químico que ocorre na sua superfície. Este papel pode mudar dependendo do fluxo de eletricidade.
O Ânodo: Local da Oxidação
O ânodo é definido como o eletrodo onde ocorre a oxidação. Este é um processo em que uma espécie química perde eletrões.
Um auxílio de memória simples é "An Ox" (Ânodo é Oxidação).
O Cátodo: Local da Redução
O cátodo é o eletrodo onde ocorre a redução. Este é um processo em que uma espécie química ganha eletrões.
Um auxílio de memória correspondente é "Red Cat" (Redução no Cátodo).
A Distinção Crítica: Sinal vs. Função
Um ponto comum de confusão é se o ânodo e o cátodo são positivos ou negativos. Isto depende inteiramente do tipo de célula eletroquímica.
Numa Célula Galvânica (como uma Bateria)
Uma célula galvânica produz eletricidade a partir de uma reação espontânea.
- O Ânodo é o terminal Negativo (-). É a fonte de eletrões da reação de oxidação.
- O Cátodo é o terminal Positivo (+). É para onde os eletrões fluem para causar a reação de redução.
Numa Célula Eletrolítica (como para Galvanoplastia)
Uma célula eletrolítica usa eletricidade externa para impulsionar uma reação não espontânea.
- O Ânodo é o terminal Positivo (+). Está ligado à extremidade positiva da fonte de alimentação, atraindo ânions para serem oxidados.
- O Cátodo é o terminal Negativo (-). Está ligado à extremidade negativa da fonte de alimentação, atraindo cátions para serem reduzidos.
Classificação por Material: Ativo vs. Inerte
A segunda classificação principal descreve se o próprio material do eletrodo faz parte da reação química.
Eletrodos Ativos
Um eletrodo ativo (ou eletrodo reativo) é um participante na semirreação. É feito de um material que é oxidado ou é o produto de uma redução.
Por exemplo, numa bateria de zinco-cobre, o ânodo de zinco dissolve-se fisicamente (oxida-se) em iões de zinco (Zn → Zn²⁺ + 2e⁻). O próprio eletrodo é consumido.
Eletrodos Inertes
Um eletrodo inerte simplesmente fornece uma superfície para que a oxidação ou redução ocorra sem participar na reação em si. Atua como um catalisador e um condutor elétrico.
Eletrodos inertes comuns incluem platina (Pt) e grafite (carbono). São usados quando as espécies que estão a ser oxidadas ou reduzidas são iões ou gases na solução.
Caso Especial: O Eletrodo Bipolar
Um eletrodo bipolar é um condutor especializado colocado numa solução eletrolítica que não está diretamente ligado à fonte de alimentação.
Funciona simultaneamente como ânodo no lado virado para o cátodo principal e como cátodo no lado virado para o ânodo principal, possibilitando uma série de reações dentro de uma única célula.
Tomando a Decisão Certa
A sua compreensão dos eletrodos deve guiar a forma como analisa um sistema eletroquímico. O "tipo" de eletrodo é definido pelo seu contexto dentro da célula.
- Se estiver a analisar uma bateria (célula galvânica): Identifique o local da oxidação como o ânodo negativo e o local da redução como o cátodo positivo.
- Se estiver a analisar um processo eletrolítico (ex: galvanoplastia): Identifique o eletrodo ligado ao terminal positivo como o ânodo (oxidação) e o ligado ao terminal negativo como o cátodo (redução).
- Ao projetar um experimento: Deve decidir se necessita de um eletrodo ativo que participe na reação ou de um eletrodo inerte para simplesmente facilitar uma reação entre espécies já presentes na solução.
Ao focar-se na função e no envolvimento do material, pode descrever e prever com precisão o comportamento de qualquer eletrodo em qualquer sistema eletroquímico.
Tabela de Resumo:
| Classificação | Tipo | Papel Principal | Exemplos Comuns |
|---|---|---|---|
| Por Função | Ânodo | Local da Oxidação (perde eletrões) | Varia consoante o tipo de célula |
| Cátodo | Local da Redução (ganha eletrões) | Varia consoante o tipo de célula | |
| Por Material | Ativo | Participa na reação | Zinco, Cobre |
| Inerte | Fornece superfície para a reação (não reativo) | Platina, Grafite | |
| Especializado | Bipolar | Funciona como ânodo e cátodo | Usado em designs de células específicos |
Precisa dos eletrodos certos para a sua aplicação eletroquímica? A KINTEK especializa-se em equipamentos e consumíveis de laboratório de alta qualidade, incluindo eletrodos inertes duráveis feitos de platina e grafite, concebidos para precisão e fiabilidade no seu laboratório. Deixe que os nossos especialistas o ajudem a selecionar os componentes perfeitos para a sua investigação ou processo. Contacte-nos hoje para discutir as suas necessidades específicas!
Guia Visual
Produtos relacionados
- Eletrodo de Ouro Eletroquímico em Folha de Ouro
- Eletrodo Eletroquímico de Disco Metálico
- Eletrodo de Referência Calomelano Cloreto de Prata Sulfato de Mercúrio para Uso Laboratorial
- Eletrodo de Disco de Platina Rotativo para Aplicações Eletroquímicas
- Eletrodo de Disco de Ouro
As pessoas também perguntam
- Por que um eletrodo de prata/cloreto de prata (Ag/AgCl) é usado para testes de células radioativas? Garanta Estabilidade e Precisão
- Qual é o propósito de realizar a polarização anódica em eletrodos BDD? Garanta resultados de pesquisa precisos e reproduzíveis
- Quais são as precauções essenciais para manusear eletrodos de grafite? Garanta a Segurança e Maximize o Desempenho
- Que precauções devem ser tomadas ao conectar um eletrodo de disco de platina? Garanta Medições Precisas e Longevidade
- Que precauções devem ser tomadas para evitar danos mecânicos a um eletrodo de placa de ouro? Proteja a Integridade dos Seus Dados
- Qual é o uso específico de cátodos de folha de cobre na recuperação de ímãs SmCo? Otimizar os resultados da eletrodeposição de ligas
- Qual é a diretriz mais crítica para imergir um eletrodo de folha de platina em um eletrólito? Garanta Medições Eletroquímicas Precisas
- Qual é a função principal do eletrodo Ti/Ta2O5–IrO2? Acelerar a Degradação do Ácido Acrílico com Tecnologia DSA



















