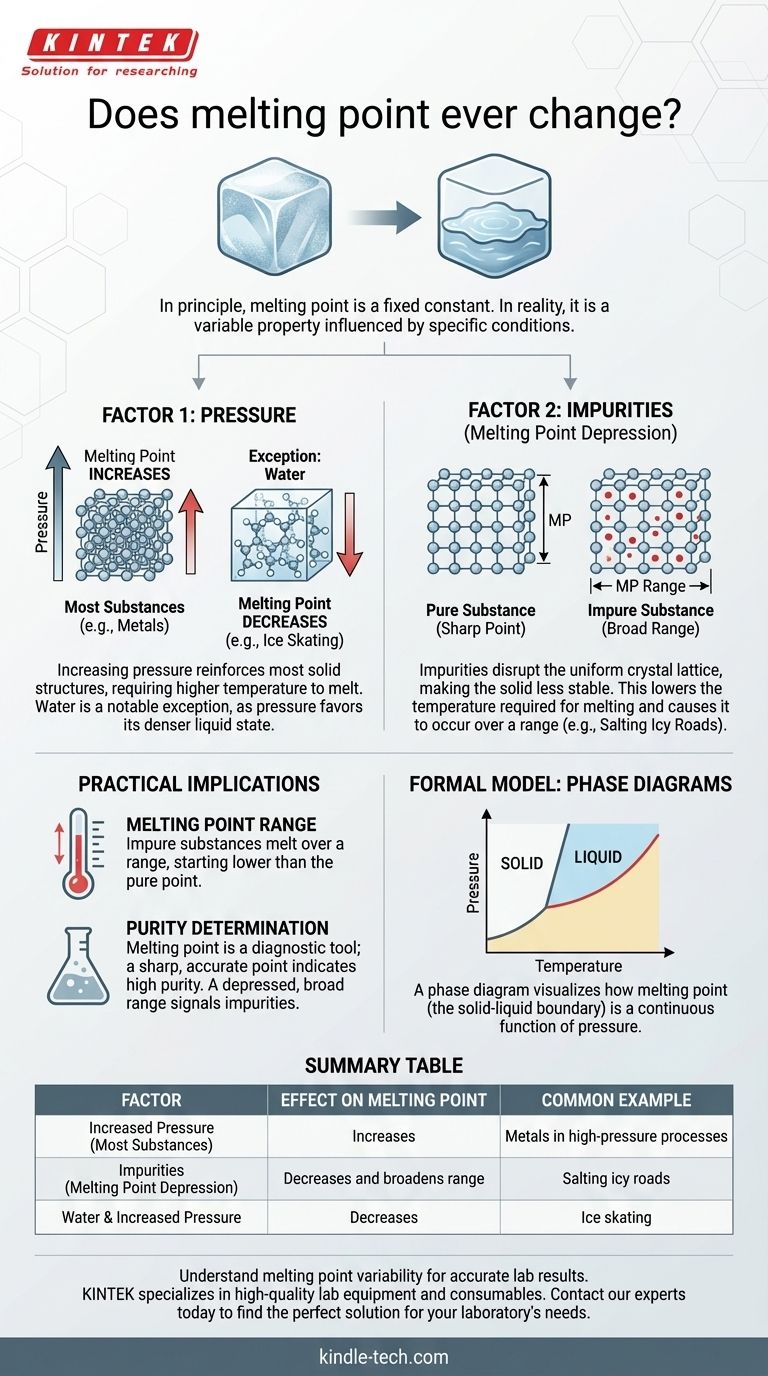
Em princípio, o ponto de fusão de uma substância pura é uma constante física fixa. No entanto, no mundo real, a temperatura observada na qual uma substância se funde pode, de facto, mudar. Esta não é uma mudança arbitrária; é uma resposta previsível a dois fatores primários: mudanças na pressão ambiente e a introdução de impurezas na substância.
Embora os livros didáticos frequentemente apresentem o ponto de fusão como um número estático, ele é mais precisamente entendido como uma propriedade que é constante apenas sob um conjunto específico de condições. Compreender como a pressão e a pureza influenciam esta propriedade é a chave para prever e controlar o seu comportamento em qualquer aplicação no mundo real.

Os Dois Fatores Que Alteram o Ponto de Fusão
O ponto de fusão "oficial" de uma substância, como a água a 0°C (32°F), é medido sob condições padrão — tipicamente a uma atmosfera de pressão e com a substância num estado altamente puro. Quando estas condições não são satisfeitas, o ponto de fusão irá desviar-se.
Fator 1: A Influência da Pressão
Para a maioria das substâncias, o aumento da pressão externa força as moléculas para um arranjo mais compacto. Isso reforça a estrutura sólida, exigindo mais energia (uma temperatura mais alta) para quebrar as ligações e fazer a transição para um líquido.
Portanto, para a grande maioria dos materiais, um aumento na pressão leva a um aumento no ponto de fusão.
Existe, no entanto, uma exceção crítica e famosa: a água. A água sólida (gelo) é menos densa que a água líquida, razão pela qual os icebergs flutuam. O aumento da pressão sobre o gelo favorece o estado mais denso — a água líquida. Isso significa que, sob maior pressão, o gelo derrete a uma temperatura mais baixa. É por isso que a lâmina de um patim de gelo, ao exercer alta pressão sobre uma linha fina, pode criar uma camada microscópica de água para deslizar.
Fator 2: O Papel das Impurezas
Esta é a razão mais comum para uma mudança no ponto de fusão fora de um laboratório de alta pressão. Quando se introduz uma impureza (um soluto) numa substância pura (um solvente), ela perturba a rede cristalina uniforme e repetitiva do sólido.
Esta perturbação torna a estrutura sólida menos estável. Como resultado, é necessária menos energia para a quebrar e transformá-la em líquido. Este fenómeno é conhecido como depressão do ponto de fusão.
Um exemplo clássico é a salga de estradas geladas. O sal mistura-se com o gelo, diminuindo o seu ponto de fusão. Isso permite que o gelo derreta mesmo quando a temperatura ambiente do ar ainda está abaixo do ponto de congelamento normal da água.
Compreendendo as Implicações Práticas
Reconhecer que o ponto de fusão pode mudar não é apenas um exercício académico. Tem consequências significativas em ambientes científicos e industriais, onde é frequentemente usado como uma ferramenta de diagnóstico.
De um "Ponto" a um "Intervalo"
Um sólido cristalino puro tipicamente funde-se a uma temperatura muito nítida e específica. Quando se começa a aquecê-lo, a temperatura sobe até atingir o ponto de fusão, onde se mantém estável até que todo o sólido se tenha transformado em líquido.
Uma substância impura comporta-se de forma diferente. Não se funde a uma única temperatura, mas sim num intervalo de ponto de fusão. A fusão começa a uma temperatura mais baixa do que para a substância pura e completa-se a uma temperatura mais próxima, mas ainda frequentemente abaixo, do ponto de fusão da substância pura.
Usando o Ponto de Fusão para Determinar a Pureza
Esta "falha" é, na verdade, uma característica incrivelmente útil. Num laboratório de química, uma das primeiras e mais rápidas maneiras de avaliar a pureza de um composto cristalino sintetizado é medir o seu ponto de fusão.
Se o composto fundir numa ampla gama e a uma temperatura inferior ao valor da literatura, é um sinal claro de que impurezas estão presentes e que é necessária uma purificação adicional. Um ponto de fusão nítido que corresponde ao valor estabelecido é um forte indicador de alta pureza.
O Modelo Formal: Diagramas de Fase
A relação entre pressão, temperatura e o estado de uma substância (sólido, líquido, gás) é formalmente capturada num diagrama de fase.
Um Mapa de Estados Físicos
Um diagrama de fase é um gráfico com a pressão no eixo y e a temperatura no eixo x. As linhas no gráfico delineiam os limites onde a substância transita entre diferentes fases.
O Limite Sólido-Líquido
A linha que separa a fase sólida da fase líquida neste diagrama representa o ponto de fusão em todas as pressões possíveis. A visualização deste gráfico deixa imediatamente claro que o ponto de fusão não é um número único, mas uma função contínua da pressão. Este modelo visual unifica os conceitos e prova que o ponto de fusão é inerentemente variável.
Fazendo a Escolha Certa para o Seu Objetivo
A sua perspetiva sobre o ponto de fusão deve ser ditada pelo seu objetivo.
- Se o seu foco principal é a síntese ou análise química: Trate o ponto de fusão como uma ferramenta de diagnóstico crucial para a pureza. Um ponto de fusão nítido e preciso confirma o sucesso, enquanto um intervalo deprimido e amplo indica a necessidade de purificação.
- Se o seu foco principal é a ciência ou engenharia de materiais: Deve ter em conta as variações de pressão nos seus projetos. O ponto de fusão de um material ao nível do mar pode não ser o mesmo num processo industrial de alta pressão ou numa aplicação em grandes profundidades.
- Se o seu foco principal é a compreensão de fenómenos quotidianos: Use o princípio da depressão do ponto de fusão para explicar porque salgamos as estradas no inverno ou porque adicionar sal a um banho de água gelada o torna mais frio para fazer gelado.
Em última análise, reconhecer que o ponto de fusão é uma propriedade dinâmica, não um número estático, transforma-o de um simples facto numa poderosa ferramenta preditiva.
Tabela Resumo:
| Fator | Efeito no Ponto de Fusão | Exemplo Comum |
|---|---|---|
| Aumento da Pressão | Aumenta (para a maioria das substâncias) | Metais em processos de alta pressão |
| Impurezas (Depressão do Ponto de Fusão) | Diminui e alarga o intervalo | Salgar estradas geladas |
| Água e Aumento da Pressão | Diminui | Patinagem no gelo |
Precisa de controlo preciso da temperatura para o seu trabalho laboratorial?
Compreender a variabilidade do ponto de fusão é crítico para uma síntese e análise precisas. A KINTEK especializa-se em equipamentos e consumíveis de laboratório de alta qualidade, incluindo aparelhos de ponto de fusão, projetados para fornecer a fiabilidade e precisão que o seu laboratório exige.
Deixe-nos ajudá-lo a alcançar resultados consistentes e precisos. Contacte os nossos especialistas hoje para encontrar a solução perfeita para as necessidades do seu laboratório.
Guia Visual
Produtos relacionados
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de 1800℃ para Laboratório
- Forno Muffle de 1400℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- O que controla o ponto de fusão? A Hierarquia de Forças desde Ligações Iónicas a Atrações Intermoleculares
- Qual é a importância do processo de fusão? Domine os Fundamentos da Produção de Metais
- Por que o derretimento requer energia? Desvende a Ciência do Calor Latente e das Mudanças de Fase
- Qual é o princípio de funcionamento e o uso do forno mufla? Alcance Aquecimento Preciso e Livre de Contaminação
- O que afeta a taxa de fusão? Domine os Fatores Chave para um Controle Preciso



















