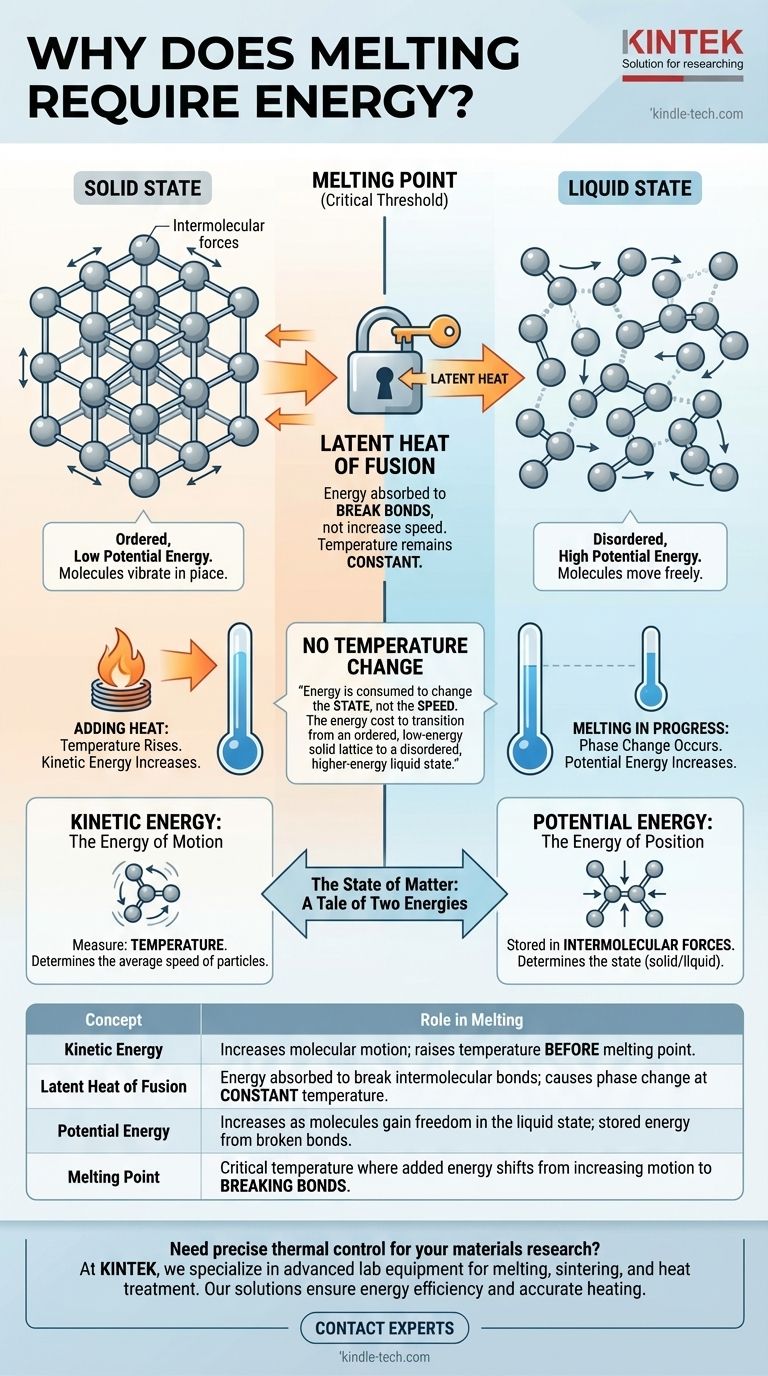
No nível molecular, o derretimento requer energia porque essa energia é usada para quebrar as ligações rígidas que mantêm as partículas unidas em uma estrutura sólida fixa. Essa energia, conhecida como calor latente, não aumenta a velocidade das moléculas — e, portanto, não eleva a temperatura — mas sim aumenta sua energia potencial, dando-lhes a liberdade de se mover e deslizar umas sobre as outras como um líquido.
A razão fundamental pela qual o derretimento requer energia sem uma mudança de temperatura é que a energia é consumida para mudar o estado, e não a velocidade, das moléculas. É o custo energético para a transição de uma rede sólida ordenada e de baixa energia para um estado líquido desordenado e de energia mais alta.

O Estado da Matéria: Uma História de Duas Energias
Para entender a energia do derretimento, devemos primeiro distinguir entre os dois tipos de energia que as moléculas possuem: cinética e potencial.
Energia Cinética: A Energia do Movimento
Energia cinética é a energia do movimento. Em uma substância, isso se manifesta como a vibração, rotação e translação de seus átomos ou moléculas constituintes.
A temperatura de uma substância é uma medida direta da energia cinética média de suas partículas. Quando você adiciona calor e a substância fica mais quente, é porque suas moléculas estão se movendo mais rapidamente.
Energia Potencial: A Energia da Posição
Energia potencial, neste contexto, é a energia armazenada nas forças entre as moléculas, conhecidas como forças intermoleculares. Ela é determinada pelo arranjo e separação dessas partículas.
Uma estrutura ordenada e firmemente ligada, como um sólido, tem baixa energia potencial. Uma estrutura desordenada e de fluxo livre, como um líquido, tem energia potencial mais alta porque as moléculas estão mais separadas e menos restritas.
O Estado Sólido: Uma Estrutura Altamente Ordenada
Em um sólido, as partículas estão presas em um padrão fixo e repetitivo chamado rede cristalina. Elas são mantidas no lugar por fortes forças intermoleculares.
Embora não estejam imóveis, sua energia cinética é limitada a vibrar no lugar. Elas não têm energia suficiente para superar as forças que as mantêm nessa estrutura rígida.
Desmistificando o Processo de Derretimento
A mudança de fase de sólido para líquido ocorre em um processo distinto e gradual, onde a energia é alocada para uma tarefa muito específica.
Adicionando Calor: O Primeiro Estágio
Quando você começa a adicionar calor a um sólido (como gelo abaixo do seu ponto de fusão), a energia é absorvida como energia cinética. As partículas vibram com mais e mais intensidade dentro da rede.
Durante este estágio, a temperatura do sólido sobe constantemente.
Atingindo o Ponto de Fusão: Um Limiar Crítico
O ponto de fusão é a temperatura na qual as partículas estão vibrando tão vigorosamente que estão prestes a se libertar da rede.
Nesta temperatura exata, ocorre uma mudança fundamental. Qualquer energia adicional adicionada não aumenta mais a velocidade de vibração (energia cinética). Em vez disso, ela é direcionada inteiramente para superar as forças intermoleculares.
O Papel do Calor Latente de Fusão
A energia necessária para mudar uma substância de sólido para líquido em seu ponto de fusão é chamada de calor latente de fusão. A palavra "latente" significa oculto, porque essa entrada de energia não resulta em uma mudança de temperatura.
Pense nisso como usar uma chave para abrir uma gaiola. A energia não está fazendo o ocupante correr mais rápido dentro da gaiola; ela está sendo usada exclusivamente para abrir a fechadura e permitir que ele saia.
Da Ordem ao Desordem: O Estado Líquido
À medida que as moléculas absorvem calor latente suficiente, elas se libertam de suas posições fixas na rede. A estrutura rígida colapsa e a substância se torna um líquido.
Neste novo estado líquido, as partículas têm energia potencial muito maior, mas sua energia cinética média (temperatura) é a mesma do sólido do qual acabaram de derreter. Somente depois que todo o sólido derreter é que a adição contínua de calor começará a aumentar a energia cinética e, assim, a temperatura do líquido.
Compreendendo a Distinção Chave: Calor vs. Temperatura
O conceito de calor latente resolve um ponto comum de confusão. Ele destaca a diferença entre adicionar energia e observar um aumento de temperatura.
O Equívoco Comum
Muitas pessoas se perguntam: "Se eu continuar adicionando calor ao gelo em derretimento, por que a temperatura permanece em 0°C (32°F)?"
A resposta é que a energia tem um trabalho diferente a fazer durante uma mudança de fase. Sua prioridade é quebrar ligações, não aumentar a velocidade.
Calor é Transferência de Energia, Temperatura é uma Medida
Calor é a transferência de energia térmica. Temperatura é uma medida da energia cinética média.
Durante o derretimento, você está continuamente transferindo calor para o sistema, mas essa energia está sendo convertida em energia potencial, deixando a energia cinética média — e, portanto, a temperatura — inalterada.
Como Aplicar Este Princípio
Compreender este conceito é fundamental para muitas aplicações do mundo real e campos científicos.
- Se seu foco principal for a observação cotidiana (como um cubo de gelo em uma bebida): A energia absorvida do líquido mais quente é usada como calor latente para quebrar as ligações moleculares do gelo, razão pela qual a bebida esfria enquanto o próprio gelo derrete a uma temperatura constante.
- Se seu foco principal for engenharia ou ciência dos materiais: O calor latente de fusão específico é uma propriedade crítica que determina o custo energético para derreter metais ou outros materiais, impactando diretamente o projeto do forno, o consumo de energia e a eficiência do processo.
- Se seu foco principal for química ou física: Lembre-se de que as mudanças de fase representam uma mudança na energia potencial (devido a mudanças nas forças intermoleculares), enquanto as mudanças de temperatura representam uma mudança na energia cinética (devido a mudanças no movimento molecular).
Compreender o papel do calor latente é a chave para entender como a energia impulsiona as mudanças no estado físico de toda a matéria.
Tabela de Resumo:
| Conceito | Papel no Derretimento |
|---|---|
| Energia Cinética | Aumenta o movimento molecular; eleva a temperatura antes do ponto de fusão. |
| Calor Latente de Fusão | Energia absorvida para quebrar ligações intermoleculares; causa mudança de fase a temperatura constante. |
| Energia Potencial | Aumenta à medida que as moléculas ganham liberdade no estado líquido; energia armazenada das ligações quebradas. |
| Ponto de Fusão | Temperatura crítica onde a energia adicionada muda de aumentar o movimento para quebrar ligações. |
Precisa de controle térmico preciso para sua pesquisa de materiais? Na KINTEK, somos especializados em equipamentos de laboratório avançados que fornecem gerenciamento preciso de aquecimento e temperatura para processos como fusão, sinterização e tratamento térmico. Se você está trabalhando com metais, cerâmicas ou outros materiais, nossas soluções garantem eficiência energética e resultados reprodutíveis. Entre em contato com nossos especialistas hoje mesmo para encontrar o forno ou sistema de aquecimento perfeito para as necessidades do seu laboratório.
Guia Visual
Produtos relacionados
- Forno Muffle de Laboratório com Muffle de Elevação Inferior
- Forno de Mufla de 1800℃ para Laboratório
- Forno Muffle de 1400℃ para Laboratório
- Forno de Mufla de 1700℃ para Laboratório
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Como você cuida de um forno mufla? Prolongue a vida útil do equipamento e garanta resultados precisos
- Um forno mufla é a vácuo? Escolhendo a Solução de Alta Temperatura Certa para o Seu Laboratório
- Como usar um forno mufla em um laboratório? Um guia passo a passo para operação segura e precisa
- O que é a análise em forno mufla? Obtenha processamento puro e de alta temperatura para seus materiais
- Qual é a taxa de resfriamento para um forno mufla? Obtenha Resfriamento Ótimo para os Processos do Seu Laboratório



















