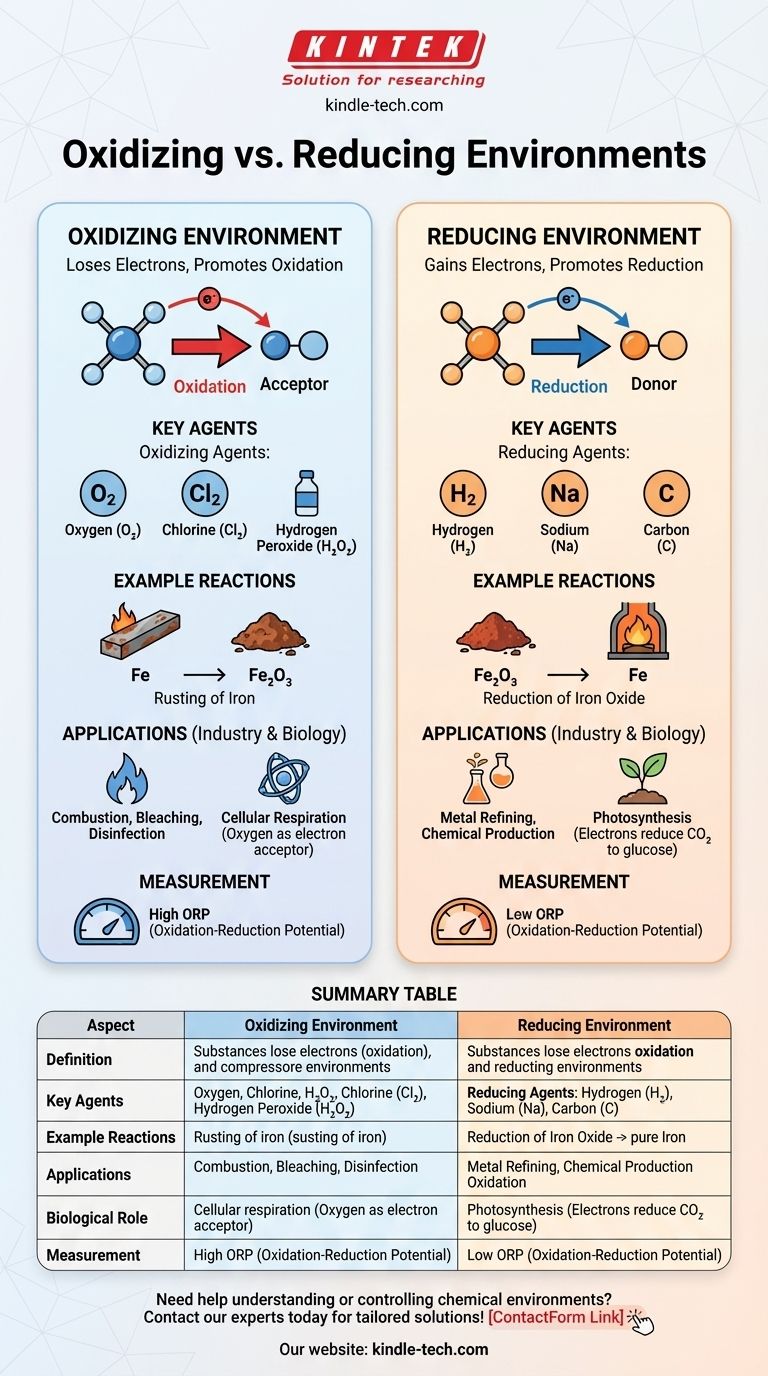
Em química, um ambiente oxidante é aquele onde as substâncias tendem a perder elétrons, promovendo reações de oxidação, enquanto um ambiente redutor é aquele onde as substâncias tendem a ganhar elétrons, promovendo reações de redução. A principal diferença reside na disponibilidade de aceitadores de elétrons (agentes oxidantes) ou doadores de elétrons (agentes redutores). Ambientes oxidantes são caracterizados pela presença de agentes oxidantes como oxigênio ou halogênios, que facilitam a perda de elétrons. Em contraste, ambientes redutores contêm agentes redutores como hidrogênio ou metais, que facilitam o ganho de elétrons. Esses ambientes desempenham papéis críticos em reações químicas, processos industriais e sistemas biológicos.

Pontos Chave Explicados:
-
Definição de Ambientes Oxidantes e Redutores:
- Ambiente Oxidante: Um ambiente químico onde as substâncias são mais propensas a perder elétrons, levando à oxidação. Este ambiente é rico em agentes oxidantes, como oxigênio, cloro ou outros aceitadores de elétrons.
- Ambiente Redutor: Um ambiente químico onde as substâncias são mais propensas a ganhar elétrons, levando à redução. Este ambiente é rico em agentes redutores, como hidrogênio, metais ou outros doadores de elétrons.
-
Papel dos Agentes Oxidantes e Redutores:
- Agentes Oxidantes: São substâncias que aceitam elétrons de outras substâncias, oxidando-as. Exemplos comuns incluem oxigênio (O₂), cloro (Cl₂) e peróxido de hidrogênio (H₂O₂).
- Agentes Redutores: São substâncias que doam elétrons para outras substâncias, reduzindo-as. Exemplos comuns incluem hidrogênio (H₂), sódio (Na) e carbono (C).
-
Reações Químicas em Diferentes Ambientes:
- Ambiente Oxidante: Em tal ambiente, as reações de oxidação dominam. Por exemplo, a ferrugem do ferro ocorre em um ambiente oxidante onde o ferro (Fe) perde elétrons para o oxigênio, formando óxido de ferro (Fe₂O₃).
- Ambiente Redutor: Em tal ambiente, as reações de redução dominam. Por exemplo, a redução de óxidos metálicos a metais puros ocorre em um ambiente redutor, como quando o carbono é usado para reduzir o óxido de ferro a ferro em um alto-forno.
-
Aplicações na Indústria e Biologia:
- Aplicações Industriais: Ambientes oxidantes são usados em processos como combustão, branqueamento e desinfecção. Ambientes redutores são cruciais em processos como refino de metais e produção de certos produtos químicos.
- Sistemas Biológicos: Em sistemas biológicos, ambientes oxidantes são encontrados em processos como a respiração celular, onde o oxigênio atua como o aceptor final de elétrons. Ambientes redutores são encontrados em processos como a fotossíntese, onde os elétrons são doados para reduzir o dióxido de carbono a glicose.
-
Medição e Controle:
- Potencial de Oxirredução (ORP): O ORP é uma medida da tendência de um ambiente químico em ganhar ou perder elétrons. Um ORP alto indica um ambiente oxidante, enquanto um ORP baixo indica um ambiente redutor.
- Controle em Processos Industriais: Nas indústrias, controlar a natureza oxidante ou redutora do ambiente é crucial para otimizar reações químicas, garantir a qualidade do produto e prevenir reações secundárias indesejadas.
-
Exemplos de Ambientes Oxidantes e Redutores:
- Ambiente Oxidante: A atmosfera terrestre é um ambiente oxidante devido à presença de oxigênio. É por isso que metais como o ferro corroem quando expostos ao ar.
- Ambiente Redutor: O interior de um alto-forno é um ambiente redutor onde o monóxido de carbono (CO) atua como agente redutor para converter minério de ferro (Fe₂O₃) em ferro metálico (Fe).
Ao compreender as diferenças entre ambientes oxidantes e redutores, químicos e engenheiros podem controlar e otimizar melhor as reações químicas em várias aplicações, desde processos industriais até sistemas biológicos.
Tabela Resumo:
| Aspecto | Ambiente Oxidante | Ambiente Redutor |
|---|---|---|
| Definição | Substâncias perdem elétrons (oxidação) devido a aceitadores de elétrons como oxigênio ou halogênios. | Substâncias ganham elétrons (redução) devido a doadores de elétrons como hidrogênio ou metais. |
| Agentes Chave | Agentes oxidantes: Oxigênio (O₂), cloro (Cl₂), peróxido de hidrogênio (H₂O₂). | Agentes redutores: Hidrogênio (H₂), sódio (Na), carbono (C). |
| Exemplos de Reações | Ferrugem do ferro (Fe → Fe₂O₃). | Redução de óxido de ferro a ferro (Fe₂O₃ → Fe). |
| Aplicações | Combustão, branqueamento, desinfecção. | Refino de metais, produção química. |
| Papel Biológico | Respiração celular (oxigênio como aceptor de elétrons). | Fotossíntese (elétrons reduzem CO₂ a glicose). |
| Medição | Alto Potencial de Oxirredução (ORP). | Baixo Potencial de Oxirredução (ORP). |
Precisa de ajuda para entender ou controlar ambientes químicos? Entre em contato com nossos especialistas hoje para soluções personalizadas!
Guia Visual
Produtos relacionados
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Equipamento de Sistema de Máquina HFCVD para Revestimento de Nano-Diamante em Matriz de Trefilação
- Forno de Tubo CVD Versátil Feito Sob Medida para Equipamentos de Sistema de Deposição Química em Fase de Vapor
- Forno de Indução a Vácuo em Escala Laboratorial
- Forno de Grafitação de Vácuo de Grafite para Material Negativo
As pessoas também perguntam
- Por que é necessária a manutenção de uma atmosfera redutora de hidrogênio para o recozimento de tungstênio? Garanta a pureza no processamento em alta temperatura
- O que é recozimento com hidrogênio? Alcance Propriedades Superiores do Material com Recozimento Brilhante
- Por que um forno industrial com controle de atmosfera de hidrogênio é necessário para a pré-sinterização de materiais Fe-Cr-Al?
- Por que um forno com atmosfera de hidrogênio é necessário para o compósito W-Cu? Desbloqueie Infiltração e Densidade Superiores
- Quais são os efeitos do hidrogênio (H2) em um ambiente de forno controlado? Dominando a Redução e o Risco












