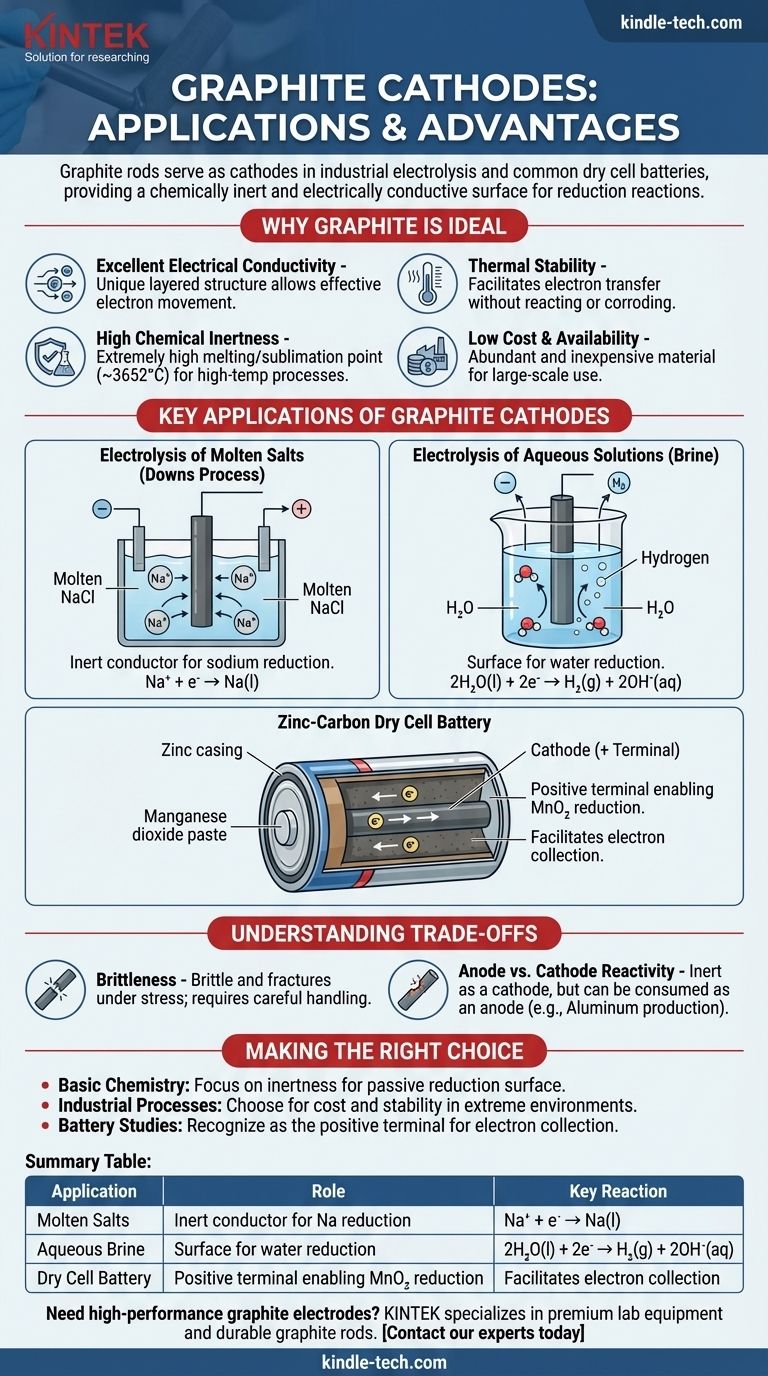
Hastes de grafite servem como cátodos em vários processos eletroquímicos chave, mais notavelmente na eletrólise industrial de sais e em pilhas secas comuns. Nessas aplicações, a função principal da haste de grafite não é ser consumida ou reagir, mas atuar como uma superfície quimicamente inerte e eletricamente condutiva onde uma reação de redução pode ocorrer.
O grafite é escolhido como material de cátodo não porque participa da reação primária, mas porque é um excelente condutor inerte. Sua combinação única de condutividade elétrica, resistência química, alta estabilidade térmica e baixo custo o torna uma plataforma ideal para a ocorrência da semirreação de redução.

Por que o Grafite é um Material de Cátodo Ideal
A seleção de um material para um eletrodo é uma escolha de design crítica em qualquer célula eletroquímica. O grafite (uma forma específica de carbono) possui um conjunto de propriedades que o tornam excepcionalmente adequado para o papel de cátodo.
Excelente Condutividade Elétrica
O grafite possui uma estrutura única em camadas e planar. Dentro dessas camadas, elétrons deslocalizados são livres para se mover, permitindo que o grafite conduza eletricidade de forma muito eficaz, uma característica necessária para qualquer eletrodo.
Alta Inércia Química
Como cátodo, o eletrodo deve facilitar a transferência de elétrons para uma substância no eletrólito sem reagir consigo mesmo. O carbono é relativamente não reativo, especialmente em comparação com a maioria dos metais, o que significa que não irá corroer ou interferir no processo químico desejado.
Estabilidade Térmica
O grafite tem um dos pontos de fusão/sublimação mais altos de todos os elementos (cerca de 3652°C ou 6606°F). Isso o torna perfeito para processos eletroquímicos de alta temperatura, como a eletrólise de sais fundidos, onde eletrodos metálicos derreteriam.
Baixo Custo e Disponibilidade
Do ponto de vista industrial, o grafite é um material abundante e barato. Isso torna a produção eletroquímica em larga escala, que requer grandes eletrodos, economicamente viável.
Principais Aplicações de Cátodos de Grafite
Compreender os casos de uso específicos esclarece a teoria. Em cada exemplo, o cátodo de grafite é simplesmente o local onde os elétrons são entregues para causar uma mudança química.
Eletrólise de Sais Fundidos (Processo Downs)
Na produção de sódio metálico puro a partir de cloreto de sódio fundido (NaCl), uma haste de grafite é frequentemente usada como cátodo. Íons de sódio carregados positivamente (Na⁺) são atraídos para o cátodo carregado negativamente, onde ganham um elétron e são reduzidos a sódio metálico líquido.
Na⁺ + e⁻ → Na(l)
O cátodo de grafite meramente fornece a superfície e os elétrons para esta reação.
Eletrólise de Soluções Aquosas (Salmoura)
Ao eletrolisar uma solução aquosa de cloreto de sódio (salmoura), o cátodo de grafite desempenha um papel semelhante. No entanto, neste caso, a água é mais fácil de reduzir do que os íons de sódio.
Portanto, as moléculas de água são reduzidas na superfície do cátodo de grafite, produzindo gás hidrogênio e íons hidróxido.
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
A Pilha Seca de Zinco-Carbono
Em uma bateria comum de "alta potência", a haste central é feita de grafite e atua como cátodo (o terminal positivo). Ela é cercada por uma pasta úmida de dióxido de manganês (MnO₂) e outros produtos químicos.
A haste de grafite coleta elétrons do circuito externo. A reação de redução ocorre na pasta adjacente à haste, onde o dióxido de manganês é reduzido. O grafite simplesmente facilita esse processo.
Compreendendo as Compensações
Embora altamente eficaz, o grafite não é um material perfeito. Reconhecer suas limitações é fundamental para entender suas aplicações.
Fragilidade
Ao contrário dos metais, que são dúcteis, o grafite é frágil e pode fraturar sob choque mecânico ou estresse. Isso requer manuseio e suporte cuidadosos em projetos industriais.
Reatividade do Ânodo vs. Cátodo
Embora o grafite seja muito inerte como cátodo, ele pode ser consumido quando usado como ânodo (o local de oxidação) em certos processos. Por exemplo, na produção de alumínio, o ânodo de carbono reage com o oxigênio produzido para formar gás CO₂ e é lentamente corroído.
Confusão Entre Tipos de Células
Um ponto comum de confusão é a polaridade do eletrodo. O cátodo é sempre o local de redução, mas seu sinal muda dependendo do tipo de célula.
- Em uma célula eletrolítica (como para eletrólise de sal), o cátodo é o terminal negativo.
- Em uma célula galvânica (como uma bateria), o cátodo é o terminal positivo.
Fazendo a Escolha Certa para o Seu Objetivo
Sua razão para perguntar sobre cátodos de grafite determina qual aspecto é mais importante focar.
- Se seu foco principal é a química básica: Lembre-se de que o grafite é um condutor inerte, fornecendo uma superfície passiva para que uma reação de redução ocorra sem reagir consigo mesmo.
- Se seu foco principal são os processos industriais: Escolha o grafite por sua relação custo-benefício e estabilidade inigualável em ambientes de alta temperatura ou corrosivos onde a maioria dos metais falharia.
- Se seu foco principal é o estudo de baterias: Reconheça que a haste de grafite em uma pilha de zinco-carbono atua como o terminal positivo (cátodo), servindo como o coletor de elétrons que permite a redução da pasta química circundante.
Em última análise, compreender o papel do grafite como cátodo é reconhecer o poder de um material inerte e condutor que permite a química sem interferir nela.
Tabela Resumo:
| Aplicação | Função do Cátodo de Grafite | Reação Chave |
|---|---|---|
| Eletrólise de Sais Fundidos (Processo Downs) | Condutor inerte para redução de sódio | Na⁺ + e⁻ → Na(l) |
| Eletrólise de Salmoura Aquosa | Superfície para redução de água | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| Pilha Seca de Zinco-Carbono | Terminal positivo que permite a redução de MnO₂ | Facilita a coleta de elétrons |
Precisa de eletrodos de grafite de alto desempenho para seus processos eletroquímicos? A KINTEK é especializada em equipamentos e consumíveis de laboratório premium, incluindo hastes de grafite duráveis projetadas para condutividade superior e estabilidade térmica. Seja para eletrólise industrial ou desenvolvimento de tecnologias de bateria, nossos materiais garantem desempenho confiável e inerte. Entre em contato com nossos especialistas hoje para encontrar a solução de grafite perfeita para as necessidades do seu laboratório!
Guia Visual
Produtos relacionados
- Placa de Carbono Grafite Fabricada por Método de Prensagem Isostática
- Material de Polimento de Eletrodos para Experimentos Eletroquímicos
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Fornalha de Grafitação a Vácuo Vertical Grande de Grafite
As pessoas também perguntam
- A grafite é um metal condutor? Descubra Por Que Este Não-Metal Impulsiona a Tecnologia Moderna
- Quais são as propriedades do grafite? Desbloqueie a Resistência e a Condutividade em Altas Temperaturas
- Qual é a função do material de grafite na preparação de corpos sinterizados de Ga-LLZO? Garanta a Integridade da Amostra em HIP
- O grafite conduz eletricidade? Desvendando os segredos de sua estrutura atômica
- Quais são os três tipos de revestimento? Um guia para revestimentos arquitetônicos, industriais e de finalidade especial



















