Não, a grafite não é um metal, mas é um excelente condutor elétrico. Esta distinção é uma fonte de confusão frequente, pois somos frequentemente ensinados a associar a condutividade exclusivamente a elementos metálicos. A grafite é um alótropo — uma forma estrutural específica — do elemento não-metal carbono.
A principal razão para esta confusão é que tendemos a agrupar materiais por categorias simples, em vez de por sua estrutura fundamental. A grafite, embora seja um não-metal, conduz eletricidade porque sua disposição atômica em camadas única cria elétrons "livres" que se comportam quase exatamente como os elétrons em um metal verdadeiro.

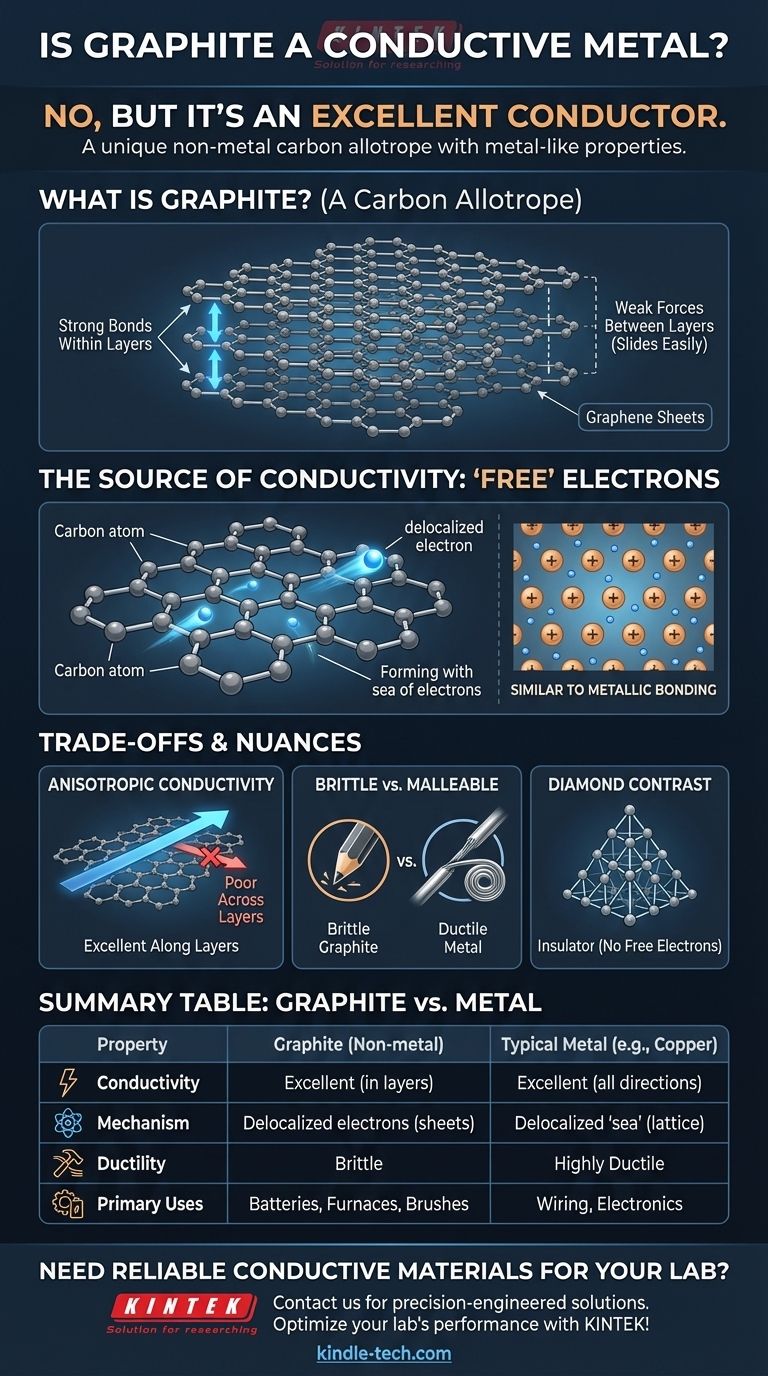
O que é Grafite? Uma Forma Única de Carbono
As propriedades da grafite surgem diretamente de sua estrutura atômica única. Compreender essa estrutura é fundamental para entender seu comportamento.
Não é um Metal, mas um Alótropo
Os elementos podem existir em diferentes formas físicas chamadas alótropos. Essas formas têm os mesmos átomos, mas diferentes arranjos estruturais, o que lhes confere propriedades vastamente diferentes.
A grafite é um alótropo do carbono. O outro alótropo mais famoso do carbono é o diamante. Embora ambos sejam carbono puro, suas estruturas tornam a grafite um condutor macio e o diamante um isolante duro.
Uma Estrutura de Camadas Empilhadas
A grafite é composta por inúmeras folhas planas empilhadas umas sobre as outras. Cada folha, conhecida como grafeno, é uma camada de átomos de carbono com um átomo de espessura, dispostos em uma rede hexagonal semelhante a um favo de mel.
As ligações que unem os átomos dentro de uma folha são incrivelmente fortes. No entanto, as forças que unem as diferentes folhas entre si são muito fracas, permitindo que elas deslizem facilmente. É por isso que a grafite é macia e escamosa, formando o "grafite" dos lápis.
A Fonte da Condutividade da Grafite
A razão pela qual a grafite conduz eletricidade reside na forma como seus elétrons são compartilhados — ou melhor, não compartilhados. Isso imita o mecanismo condutor dos metais sem que a grafite seja um metal em si.
O Papel dos Elétrons do Carbono
Cada átomo de carbono possui quatro elétrons externos (elétrons de valência) disponíveis para ligação. Na estrutura hexagonal de uma folha de grafeno, cada átomo de carbono forma fortes ligações covalentes com três átomos vizinhos.
O Elétron Deslocalizado "Livre"
Isso deixa um dos quatro elétrons de valência sem ligação. Este quarto elétron não está preso a uma ligação entre dois átomos específicos. Em vez disso, ele se torna deslocalizado, livre para se mover em qualquer lugar ao longo de sua folha de grafeno bidimensional.
Um "Mar de Elétrons" em um Não-Metal
Esta coleção de elétrons deslocalizados forma um "mar de elétrons" móvel dentro de cada camada. Como uma corrente elétrica é simplesmente o fluxo de elétrons, esses elétrons em movimento livre permitem que a grafite conduza eletricidade com facilidade.
Isso é fundamentalmente semelhante à ligação metálica, onde uma rede de íons metálicos positivos reside em um "mar" de elétrons compartilhados e deslocalizados. A grafite alcança um resultado semelhante usando uma estrutura atômica completamente diferente.
Compreendendo as Trocas e Nuances
Embora a grafite seja um condutor, não é um substituto perfeito para os metais. Sua natureza não-metálica vem com trocas distintas.
A Condutividade Não é Uniforme
A grafite é altamente anisotrópica, o que significa que suas propriedades dependem da direção. Ela conduz eletricidade extremamente bem ao longo de suas folhas de grafeno, mas muito mal através delas. A maioria dos metais, em contraste, é isotrópica e conduz eletricidade igualmente bem em todas as direções.
Fragilidade vs. Maleabilidade
Metais são tipicamente dúcteis e maleáveis, o que significa que podem ser estirados em fios ou martelados em novas formas sem quebrar. A grafite é frágil e se estilhaçará sob estresse semelhante. Você não pode formar um fio de grafite esticando-o.
Diamante: A Contraparte Isolante
O diamante oferece o contraste perfeito. Em sua rede rígida e tetraédrica, cada átomo de carbono se liga a outros quatro, usando todos os quatro elétrons de valência. Sem elétrons deslocalizados, não há nada livre para se mover e transportar uma corrente, tornando o diamante um excelente isolante elétrico.
Fazendo a Escolha Certa para Sua Aplicação
A compreensão desses princípios permite selecionar o material certo com base nas propriedades específicas exigidas para uma tarefa.
- Se seu foco principal é condutividade flexível e omnidirecional: Metais como cobre e alumínio continuam sendo a escolha superior devido à sua ductilidade e natureza isotrópica.
- Se seu foco principal é um condutor leve e quimicamente estável para altas temperaturas: A grafite é um material ideal para aplicações como eletrodos de bateria, revestimentos de fornos e escovas de motores elétricos.
- Se seu foco principal é dureza e isolamento elétrico: O diamante, o outro famoso alótropo do carbono, é a solução, provando que o arranjo atômico dita tudo.
Em última análise, as propriedades de um material são definidas por sua estrutura atômica, não pela categoria simples em que o colocamos.
Tabela Resumo:
| Propriedade | Grafite | Metal Típico (ex: Cobre) |
|---|---|---|
| Tipo de Material | Não-metal (Alótropo de Carbono) | Metal |
| Condutividade Elétrica | Excelente (dentro das camadas) | Excelente (em todas as direções) |
| Mecanismo de Condução | Elétrons deslocalizados em folhas de grafeno | 'Mar de elétrons' deslocalizados |
| Ductilidade/Maleabilidade | Frágil, não pode ser estirado em fios | Altamente dúctil e maleável |
| Principais Casos de Uso | Baterias, revestimentos de fornos, escovas de motores | Fiação, componentes estruturais, eletrônicos |
Precisa de um material condutor confiável para sua aplicação em laboratório? Seja trabalhando com fornos de alta temperatura, pesquisa de baterias ou configurações de eletrodos personalizados, a experiência da KINTEK em equipamentos e consumíveis de laboratório garante que você obtenha a solução certa. Nossa equipe pode ajudá-lo a selecionar materiais que correspondam às suas necessidades específicas de condutividade, temperatura e durabilidade. Entre em contato conosco hoje para otimizar o desempenho do seu laboratório com soluções de engenharia de precisão da KINTEK!
Guia Visual
Produtos relacionados
- Eletrodo Eletroquímico de Grafite em Disco, Haste e Chapa
- Placa de Carbono Grafite Fabricada por Método de Prensagem Isostática
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Fornalha de Grafitação a Vácuo Vertical Grande de Grafite
- Forno de Grafitação Contínua a Vácuo de Grafite
As pessoas também perguntam
- Quais são as características e aplicações de um eletrodo de folha de grafite? Maximizando a Área de Reação para Eletrólise em Massa
- Como um eletrodo de grafite deve ser limpo e armazenado após um experimento? Garanta Dados Eletroquímicos Confiáveis
- Quais são as propriedades das varetas de grafite? Aproveite a Alta Condutividade para Aplicações Extremas
- Quais são as características e usos comuns de um eletrodo de bastão de grafite? Um Guia para Eletroquímica Durável e Simples
- Por que uma haste de grafite de alta pureza é preferida como contra-eletrodo? Garanta Análise Eletroquímica Não Contaminada



















