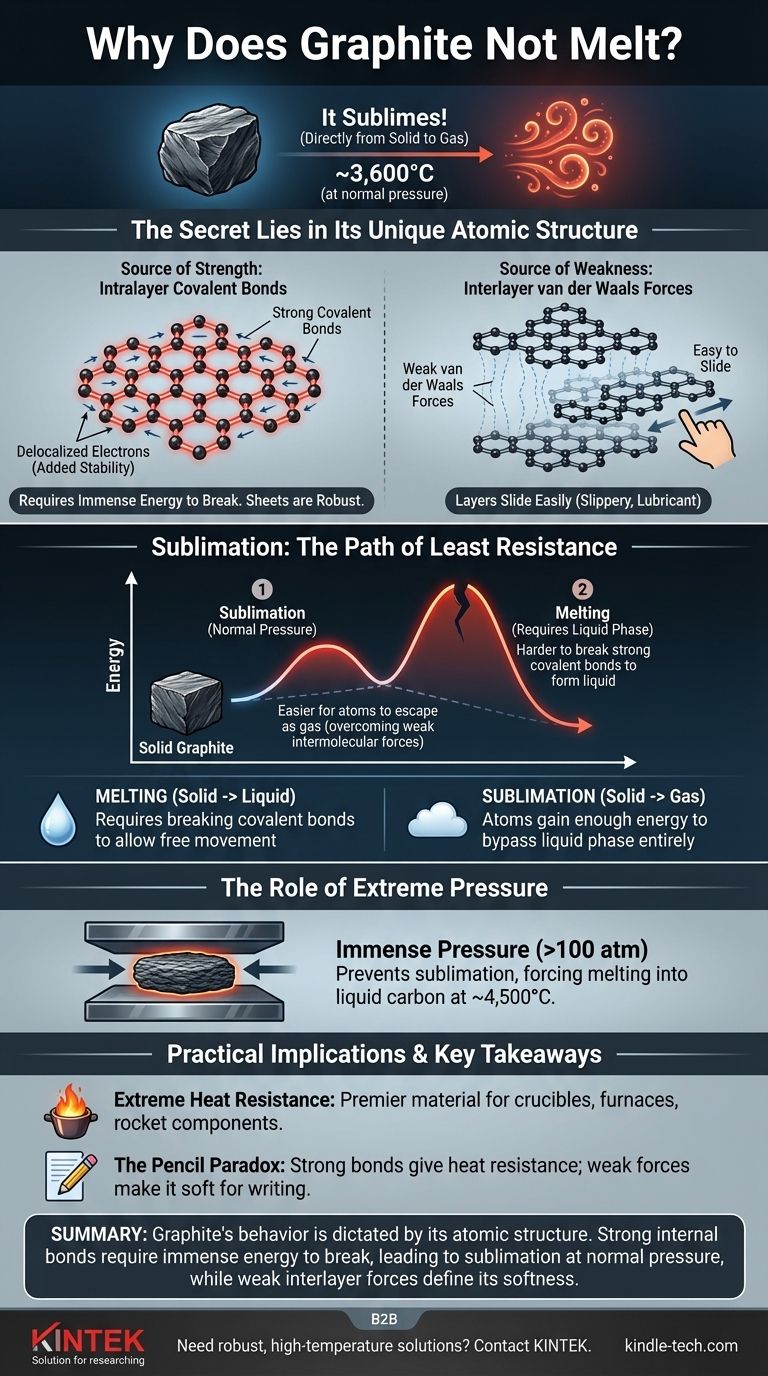
É um equívoco comum pensar que o grafite não derrete. Sob pressão atmosférica normal, o grafite faz algo diferente: ele sublima, transformando-se diretamente de um sólido em um gás a uma temperatura incrivelmente alta de cerca de 3.600°C (6.500°F). Esse comportamento é um resultado direto da imensa força das ligações químicas que mantêm seus átomos de carbono unidos.
A razão principal para a extrema resistência ao calor do grafite é sua estrutura atômica única. Ele consiste em camadas de átomos de carbono unidos por ligações covalentes excepcionalmente fortes, que exigem uma quantidade tremenda de energia para serem quebradas e permitir que a substância mude de estado.

Desconstruindo a Estrutura Atômica do Grafite
Para entender por que o grafite se comporta dessa maneira, devemos observar como seus átomos de carbono estão organizados. Sua estrutura é definida por dois tipos muito diferentes de ligações químicas trabalhando ao mesmo tempo.
A Fonte da Força: Ligações Covalentes Dentro das Camadas
O grafite é composto por folhas planas e bidimensionais de átomos de carbono dispostos em uma rede hexagonal, semelhante a um favo de mel.
Dentro de cada folha, cada átomo de carbono está ligado a outros três por fortes ligações covalentes. Estas estão entre as ligações químicas mais poderosas da natureza.
Além disso, um elétron de cada átomo de carbono torna-se deslocalizado, o que significa que ele está livre para se mover por toda a folha. Esse compartilhamento de elétrons entre todos os átomos na camada adiciona estabilidade significativa e fortalece ainda mais as ligações, tornando as folhas incrivelmente robustas e difíceis de quebrar.
A Fonte da Fraqueza: Forças Entre as Camadas
Embora os átomos dentro de uma camada estejam fortemente ligados, as próprias camadas são mantidas unidas por forças muito mais fracas, conhecidas como forças de van der Waals.
Essas forças são fracas o suficiente para que as camadas possam deslizar facilmente umas sobre as outras. É por isso que o grafite é escorregadio e é usado como lubrificante e em lápis — a escrita deixa camadas de grafite no papel.
Sublimação: O Caminho de Menor Resistência
A diferença extrema entre as fortes ligações dentro das camadas e as fracas forças entre elas dita como o grafite responde ao calor.
Fusão vs. Sublimação
A fusão é o processo de um sólido se transformar em líquido. Para que isso aconteça, os átomos devem ganhar energia suficiente para se libertarem de suas posições fixas, mas ainda permanecerem atraídos uns pelos outros.
A sublimação é a transição direta de um sólido para um gás. Neste caso, os átomos ganham tanta energia que ignoram completamente a fase líquida e escapam para o ar.
Por Que a Sublimação Vence em Pressão Normal
À pressão atmosférica padrão, a energia necessária para quebrar as poderosas ligações covalentes dentro das camadas de grafite é imensa.
Antes que a estrutura possa absorver energia suficiente para derreter em um líquido, os átomos na superfície ganham energia suficiente para superar as fracas forças intermoleculares e simplesmente voam como um gás. É energeticamente mais fácil para os átomos escaparem diretamente para o estado gasoso do que quebrar as ligações covalentes necessárias para formar um líquido.
O Papel da Pressão Extrema
O grafite pode ser forçado a derreter, mas apenas sob condições extraordinárias.
Ao aplicar uma pressão imensa (mais de 100 vezes a pressão atmosférica normal), você pode impedir que os átomos de carbono escapem como gás. Sob essas condições, o grafite derreterá em carbono líquido a uma temperatura de aproximadamente 4.500°C (8.132°F).
As Implicações Práticas Desta Estrutura
Esta estrutura única de dupla ligação confere ao grafite um conjunto de propriedades que parecem contraditórias, mas são essenciais para suas aplicações industriais.
Resistência Extrema ao Calor
O alto ponto de sublimação torna o grafite um material de primeira linha para ambientes de alta temperatura. É usado para fazer cadinhos para derreter metais, revestimentos para fornos e componentes em motores de foguete que devem suportar calor enorme.
O Paradoxo do Lápis
A estrutura do grafite explica como ele pode ser incrivelmente resistente ao calor e surpreendentemente macio. A força vem das ligações covalentes dentro das camadas, enquanto a maciez e as propriedades lubrificantes vêm da facilidade com que essas camadas deslizam umas sobre as outras.
Principais Conclusões para Entender o Grafite
- Se o seu foco principal é o seu comportamento sob calor: Lembre-se de que, em pressão normal, o grafite sublima diretamente para um gás porque a energia necessária para isso é menor do que a energia necessária para quebrar as ligações covalentes e formar um líquido.
- Se o seu foco principal são as suas propriedades físicas: A chave é a sua estrutura em camadas. Ligações fortes dentro das camadas proporcionam resistência ao calor, enquanto forças fracas entre as camadas o tornam macio e um lubrificante eficaz.
- Se o seu foco principal é a definição técnica de fusão: O grafite pode absolutamente derreter, mas apenas sob pressão extremamente alta que impede que os átomos sublimem primeiro.
Em última análise, o comportamento do grafite é uma ilustração perfeita de como a estrutura atômica de um material dita suas propriedades no mundo real.
Tabela Resumo:
| Propriedade | Descrição | Razão Principal |
|---|---|---|
| Ponto de Sublimação | ~3.600°C (à pressão normal) | Fracas forças de van der Waals entre as camadas permitem que os átomos escapem como gás antes de derreter. |
| Ponto de Fusão | ~4.500°C (sob pressão extrema >100 atm) | A alta pressão impede a sublimação, forçando as ligações covalentes a se quebrarem para a fusão. |
| Resistência ao Calor | Excelente para aplicações de alta temperatura | Ligações covalentes extremamente fortes dentro das camadas de carbono exigem imensa energia para quebrar. |
Precisa de soluções robustas e de alta temperatura para o seu laboratório?
As propriedades únicas do grafite o tornam um material essencial para aplicações exigentes. Na KINTEK, somos especializados em fornecer equipamentos e consumíveis de laboratório de alta qualidade, incluindo cadinhos de grafite e componentes de forno, projetados para suportar condições extremas.
Deixe nossos especialistas ajudá-lo a selecionar os materiais certos para aumentar a eficiência e segurança do seu laboratório. Entre em contato com a KINTEK hoje para discutir suas necessidades específicas de alta temperatura!
Guia Visual
Produtos relacionados
- Forno Vertical de Grafitação a Vácuo de Alta Temperatura
- Forno de Grafitação a Vácuo de Ultra-Alta Temperatura de Grafite
- Forno de Grafitação de Filme de Alta Condutividade Térmica de Grafite
- Forno de Grafitação Contínua a Vácuo de Grafite
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Quais são as desvantagens do revestimento de grafeno? Custo Elevado, Aplicação Difícil e Marketing Enganoso
- Quais são as desvantagens da metalurgia do pó? Principais Limitações em Força e Tamanho
- Quais são as vantagens e desvantagens da conformação a frio em relação à conformação a quente? Um Guia para Escolher o Processo Certo de Conformação de Metais
- Como o tamanho da partícula afeta a sinterização? Alcance Resultados Mais Rápidos e Densos com Pós Finos
- Como o plástico pode ser usado como combustível? Transforme Resíduos em Energia com Pirólise e Foto-reforma
- Qual é a tensão em filmes finos por pulverização catódica? Controle as Forças Internas para um Desempenho Confiável do Filme
- Qual é o desenvolvimento de filmes finos? De Experimentos do Século XVII à Engenharia em Escala Atômica
- Quais são os benefícios de se manter atualizado com as mais recentes tecnologias de ultracongeladores (ULT)? Economize Custos e Aumente a Sustentabilidade



















