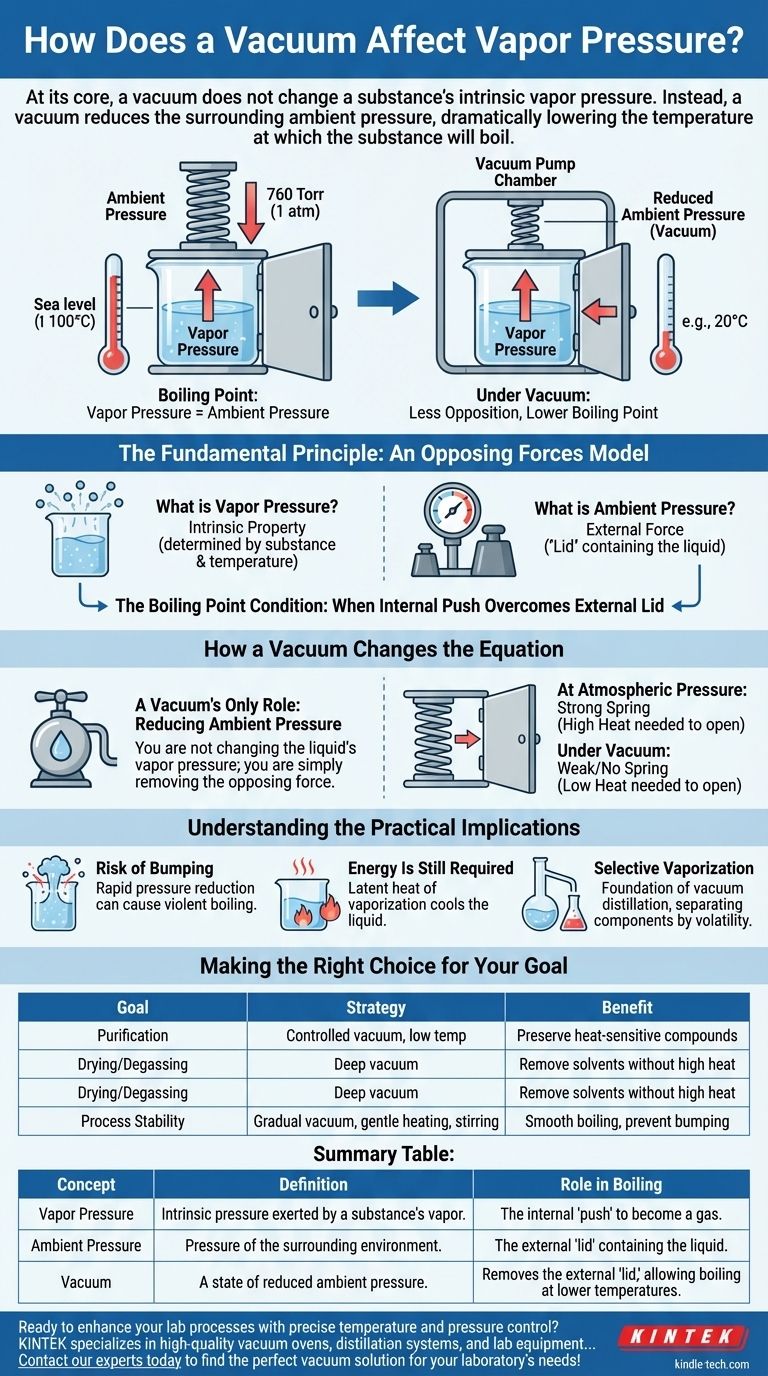
Em sua essência, um vácuo não altera a pressão de vapor intrínseca de uma substância. Em vez disso, um vácuo reduz a pressão ambiente circundante, o que diminui drasticamente a temperatura na qual a substância irá ferver. A pressão de vapor de uma substância é uma propriedade fundamental determinada apenas pela própria substância e sua temperatura.
A ebulição ocorre quando a pressão de vapor interna de um líquido se iguala ou excede a pressão externa que a pressiona. Um vácuo simplesmente remove essa pressão externa, tornando muito mais fácil para a pressão de vapor do líquido "vencer" e iniciar a ebulição, mesmo em temperaturas muito mais baixas.
O Princípio Fundamental: Um Modelo de Forças Opostas
Para entender o papel de um vácuo, você deve primeiro distinguir entre dois conceitos chave: o "empurrão" interno do líquido e o "empurrão" externo do ambiente.
O que é Pressão de Vapor?
Pressão de vapor é a pressão exercida pelo vapor de uma substância quando está em equilíbrio com sua fase líquida ou sólida. Pense nisso como a tendência inerente da substância de escapar e se tornar um gás.
Esta propriedade é intrínseca ao material e é primariamente uma função da temperatura. À medida que você adiciona calor, as moléculas se movem mais rápido e mais delas têm energia suficiente para escapar da superfície do líquido, aumentando a pressão de vapor.
O que é Pressão Ambiente?
Pressão ambiente é a pressão do ambiente circundante que pressiona a superfície da substância. Ao nível do mar, este é o peso da atmosfera acima de nós (aproximadamente 760 Torr ou 1 atm).
Esta força externa atua como uma "tampa", contendo o líquido e dificultando a fuga das moléculas.
A Condição do Ponto de Ebulição
Um líquido ferve quando seu empurrão interno supera a tampa externa. A definição técnica do ponto de ebulição é a temperatura na qual a pressão de vapor é igual à pressão ambiente. Esta é a relação crítica a ser compreendida.
Como um Vácuo Altera a Equação
Um sistema de vácuo não interage com as moléculas do líquido para alterar suas propriedades inerentes. Sua única função é alterar o ambiente externo.
A Única Função de um Vácuo: Reduzir a Pressão Ambiente
Uma bomba de vácuo funciona removendo moléculas de gás (como ar) de uma câmara selada. Ao remover essas moléculas, ela reduz drasticamente a pressão ambiente que pressiona o líquido interno.
Você não está alterando a pressão de vapor do líquido; você está simplesmente removendo a força oposta.
Atingindo o Ponto de Ebulição Mais Cedo
Imagine tentar abrir uma porta com mola. A pressão de vapor é a força que você aplica à porta, e a pressão ambiente é a força da mola que empurra de volta.
- À Pressão Atmosférica: A mola é forte. Você precisa empurrar com muita força (adicionar muito calor) para abrir a porta (fazer o líquido ferver).
- Sob Vácuo: Você removeu a mola. Agora, até mesmo um empurrão suave (uma pequena quantidade de calor) é suficiente para abrir a porta facilmente.
A natureza da porta não mudou, apenas a oposição. É por isso que a água, que ferve a 100°C (212°F) ao nível do mar, pode ferver à temperatura ambiente sob um vácuo suficiente.
Compreendendo as Implicações Práticas
Aplicar um vácuo é uma técnica poderosa, mas vem com comportamentos e limitações específicas que você deve gerenciar.
Risco de "Bumping" (Erupção Violenta)
Se a pressão for reduzida muito rapidamente, o líquido pode ficar superaquecido. A energia se acumula sem ferver até irromper em um único evento violento conhecido como bumping. É por isso que a aplicação controlada e gradual do vácuo e a agitação são críticas em ambientes laboratoriais e industriais.
Ainda é Necessária Energia
Mesmo sob vácuo perfeito, a ebulição não é instantânea ou "gratuita". A mudança de fase de líquido para gás (evaporação) ainda requer energia, conhecida como calor latente de vaporização. Se não houver fonte de calor externa, o líquido retirará essa energia de si mesmo, fazendo com que sua temperatura caia rapidamente. Este é o princípio por trás da liofilização (secagem por congelamento).
Vaporização Seletiva
Todo este princípio é a base da destilação a vácuo. Dois líquidos com diferentes pontos de ebulição podem ser separados a uma temperatura baixa que impede sua degradação. A substância mais volátil (com maior pressão de vapor intrínseca) ferverá primeiro sob vácuo, deixando a substância menos volátil para trás.
Fazendo a Escolha Certa para o Seu Objetivo
Compreender essa relação permite que você controle os processos com precisão. Sua estratégia dependerá do que você está tentando alcançar.
- Se o seu foco principal for purificação: Use um vácuo controlado para separar componentes voláteis de uma mistura em baixas temperaturas, preservando compostos sensíveis ao calor.
- Se o seu foco principal for secagem ou desgaseificação: Aplique um vácuo profundo para remover solventes residuais como água ou ar de uma amostra sem precisar aquecê-la em altas temperaturas.
- Se o seu foco principal for estabilidade do processo: Combine um vácuo gradual com aquecimento suave e agitação para alcançar uma ebulição suave e evitar bumping violento.
Ao dominar a interação entre temperatura e pressão, você ganha controle preciso sobre o estado físico de seus materiais.

Tabela Resumo:
| Conceito | Definição | Papel na Ebulição |
|---|---|---|
| Pressão de Vapor | Pressão intrínseca exercida pelo vapor de uma substância. | O 'empurrão' interno do líquido para se tornar gás. |
| Pressão Ambiente | Pressão do ambiente circundante (ex: atmosfera). | A 'tampa' externa que contém o líquido. |
| Vácuo | Um estado de pressão ambiente reduzida. | Remove a 'tampa' externa, permitindo a ebulição em temperaturas mais baixas. |
Pronto para aprimorar seus processos de laboratório com controle preciso de temperatura e pressão?
A KINTEK é especializada em estufas a vácuo de alta qualidade, sistemas de destilação e equipamentos de laboratório projetados para ebulição, secagem e purificação eficientes em baixas temperaturas. Nossas soluções ajudam você a preservar materiais sensíveis ao calor e a melhorar a estabilidade do processo.
Entre em contato com nossos especialistas hoje mesmo para encontrar a solução de vácuo perfeita para as necessidades do seu laboratório!
Guia Visual
Produtos relacionados
- Chiller de Armadilha Fria Direta a Vácuo
- Refrigerador de Armadilha Fria a Vácuo Armadilha Fria Indireta
- Bomba de Vácuo Vertical de Circulação de Água para Laboratório
- Placa Cega de Flange a Vácuo de Aço Inoxidável KF ISO para Sistemas de Alto Vácuo
- Forno de Sinterização e Brasagem por Tratamento Térmico a Vácuo
As pessoas também perguntam
- Onde são utilizados os fornos a vácuo? Essenciais para Tratamento Térmico de Alta Pureza em Indústrias Críticas
- Que gás a pirólise produz? Uma mistura de gás combustível para energia e sustentabilidade
- O que é pirólise ultrarrápida? Desbloqueie Produtos Químicos de Alto Valor da Biomassa em Milissegundos
- A brasagem pode ser usada para unir metais dissimilares? Obtenha Juntas Fortes e Confiáveis Sem Fusão
- Qual é a principal função das fornalhas de alta temperatura na caracterização mecânica? Simulando a Realidade Extrema
- Como um forno a vácuo é utilizado no processo de produção de chapas de eletrodo de bateria LiFePO4/C? Garanta Segurança e Longevidade
- Qual é o ponto crítico do tratamento térmico? Domine a Chave para a Transformação do Aço
- É possível soldar cobre com latão sem fluxo? Sim, mas apenas sob estas condições específicas.



















