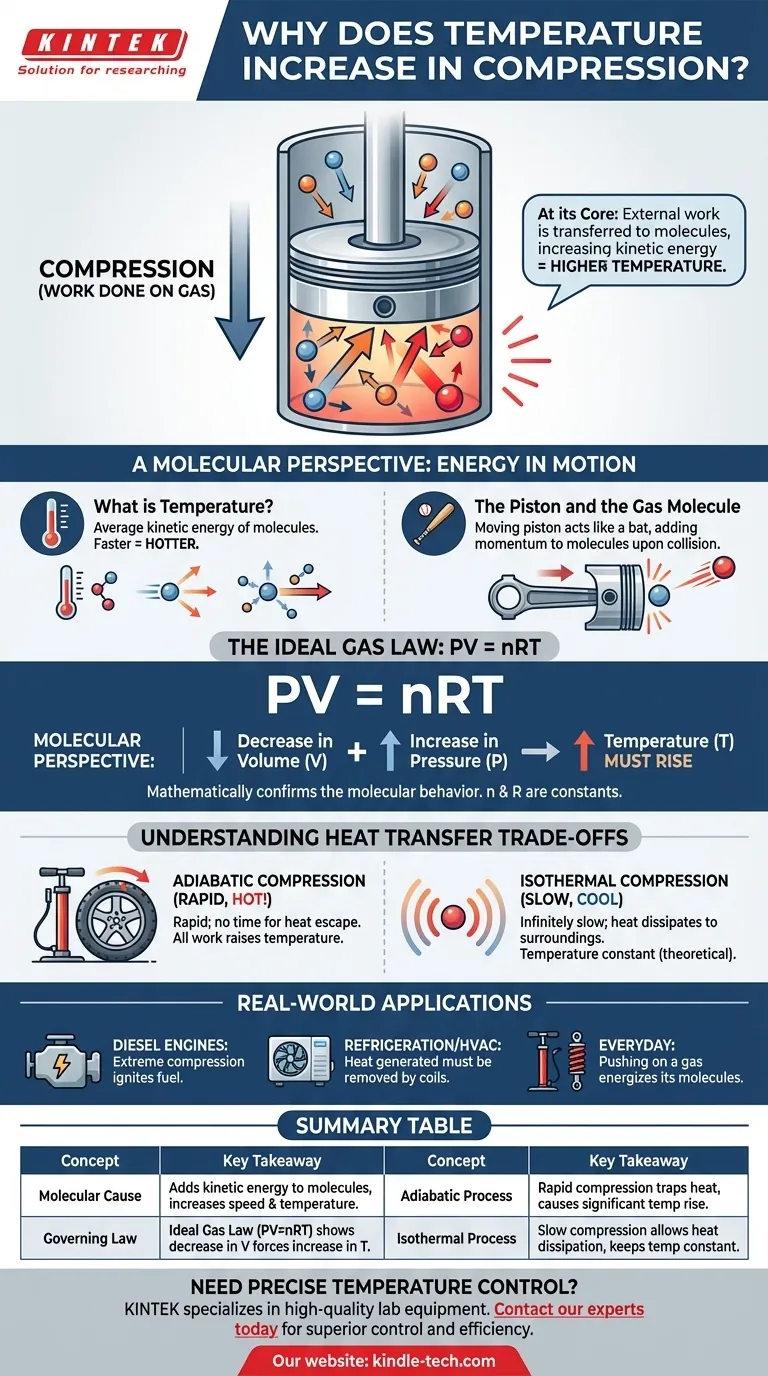
Em sua essência, comprimir um gás aumenta sua temperatura porque você está realizando trabalho sobre ele. Este trabalho externo é transferido diretamente para as moléculas do gás, aumentando sua energia cinética. Medimos esse aumento na energia cinética média das moléculas como uma elevação na temperatura.
O ato de compressão não é meramente uma redução de volume; é uma injeção de energia. A força que você aplica para comprimir o gás adiciona energia às suas moléculas, fazendo-as mover-se mais rapidamente, o que percebemos como calor.

Uma Perspectiva Molecular: Energia em Movimento
Para realmente entender o aquecimento por compressão, devemos pensar no que está acontecendo na escala das moléculas individuais. A temperatura de um gás é simplesmente uma medida do movimento médio de suas incontáveis partículas.
O Que é Temperatura, Realmente?
Temperatura é uma medida macroscópica da energia cinética média das moléculas em um sistema. Moléculas que se movem mais rapidamente possuem mais energia cinética, resultando em uma temperatura mais alta. Moléculas que se movem mais lentamente significam uma temperatura mais baixa.
O Ato de Compressão
Imagine um gás contido em um cilindro com um pistão móvel. Para comprimir o gás, você deve empurrar fisicamente o pistão para dentro, aplicando força sobre uma distância. Esta ação é a definição científica de trabalho.
O Pistão e a Molécula de Gás
Pense no pistão em movimento como um taco e uma molécula de gás como uma bola. Quando uma molécula colide com um pistão estacionário, ela ricocheteia com a mesma velocidade. No entanto, quando ela colide com um pistão que está se movendo para dentro, o pistão adiciona momento e energia à molécula, fazendo-a ricochetear com uma velocidade maior.
O Efeito Coletivo
Essa transferência de energia acontece bilhões de vezes por segundo com todas as moléculas atingindo a face do pistão. Cada colisão adiciona uma pequena quantidade de energia. O resultado cumulativo é um aumento significativo na velocidade média – e, portanto, na energia cinética média – de toda a população de moléculas, fazendo com que a temperatura do gás suba.
O Papel da Lei dos Gases Ideais
Esse comportamento molecular é descrito matematicamente por leis físicas fundamentais, mais simplesmente pela Lei dos Gases Ideais. Ela fornece uma confirmação de alto nível do que vemos no nível molecular.
A Equação Governante: PV = nRT
A Lei dos Gases Ideais relaciona a pressão (P), o volume (V) e a temperatura (T) de uma dada quantidade de gás (n). O 'R' é uma constante. Esta equação mostra que essas propriedades estão intrinsecamente ligadas.
Como a Lei Prevê o Resultado
Quando você comprime um gás, você diminui seu volume (V). A força que você aplica também aumenta sua pressão (P). Para que a equação PV = nRT permaneça equilibrada, um aumento no lado esquerdo da equação (da combinação de P aumentando e V diminuindo) deve ser correspondido por um aumento no lado direito. Como n e R são constantes, a temperatura (T) deve subir.
Compreendendo as Trocas: Transferência de Calor
A taxa de compressão altera drasticamente o resultado porque determina quanto tempo o sistema tem para interagir com o ambiente.
Compressão Adiabática (Sem Escape de Calor)
Isso ocorre quando a compressão é tão rápida que não há tempo para o calor gerado escapar para o ambiente. Todo o trabalho que você realiza é convertido diretamente no aumento da energia interna e da temperatura do gás. Bombear um pneu de bicicleta é um exemplo real próximo; a bomba fica visivelmente quente.
Compressão Isotérmica (Escape Perfeito de Calor)
Este é um ideal teórico que ocorre quando a compressão é feita infinitamente lentamente. Esse ritmo lento permite que todo o calor extra gerado pelo trabalho se dissipe para o ambiente, mantendo a temperatura do gás constante. Embora não seja praticamente alcançável, é um conceito crítico para a análise termodinâmica.
O Cenário do Mundo Real
Quase todos os processos do mundo real se situam entre esses dois extremos. Parte do trabalho realizado aumenta a temperatura interna, enquanto parte do calor gerado é perdida para o ambiente.
Como Aplicar Este Princípio
Compreender o aquecimento por compressão não é apenas acadêmico; é fundamental para inúmeras aplicações e sistemas do mundo real.
- Se o seu foco principal são os fenômenos cotidianos: Lembre-se de que empurrar um gás (realizar trabalho) energiza suas moléculas, razão pela qual uma bomba de bicicleta ou um amortecedor esquenta.
- Se o seu foco principal é o projeto de motores: Este princípio é a própria base do motor diesel, que usa compressão extrema para aquecer o ar o suficiente para inflamar o combustível sem uma vela de ignição.
- Se o seu foco principal é refrigeração ou AVAC: O calor gerado durante a fase de compressão de um refrigerante é o calor residual que deve ser ativamente removido pelas serpentinas do condensador na parte traseira de sua geladeira ou em sua unidade de ar condicionado externa.
Em última análise, a ligação entre trabalho mecânico e energia térmica é uma lei fundamental da física, transformando força em calor no nível molecular.
Tabela Resumo:
| Conceito | Principal Conclusão |
|---|---|
| Causa Molecular | A compressão adiciona energia cinética às moléculas de gás, aumentando sua velocidade e temperatura. |
| Lei Governante | A Lei dos Gases Ideais (PV=nRT) mostra matematicamente que uma diminuição no volume (V) força um aumento na temperatura (T). |
| Processo Adiabático | A compressão rápida (por exemplo, bomba de bicicleta) retém o calor, causando um aumento significativo da temperatura. |
| Processo Isotérmico | A compressão lenta e teórica permite que o calor se dissipe, mantendo a temperatura constante. |
| Impacto no Mundo Real | Fundamental para motores diesel, ciclos de refrigeração e sistemas de AVAC. |
Precisa de controle preciso de temperatura para seus processos? Os princípios da termodinâmica são críticos para P&D e aplicações industriais. A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, atendendo às necessidades exigentes de laboratórios. Seja você desenvolvendo novos materiais ou otimizando sistemas térmicos, nossa expertise pode apoiar seu trabalho. Entre em contato com nossos especialistas hoje para discutir como podemos ajudá-lo a alcançar controle e eficiência superiores em seu laboratório.
Guia Visual
Produtos relacionados
- Prensa Isostática a Quente WIP Estação de Trabalho 300Mpa para Aplicações de Alta Pressão
- Prensa de Aquecimento de Placa Dupla para Laboratório
- Molde de Prensagem Anti-Rachadura para Uso em Laboratório
- Máquina de Prensagem de Comprimidos de Punção Única e Máquina Rotativa de Prensagem de Comprimidos de Produção em Massa para TDP
- Máquina Elétrica de Prensagem de Comprimidos de Punção Única Laboratório Puncionamento de Comprimidos TDP Prensa de Comprimidos
As pessoas também perguntam
- Quais são os componentes de um sistema de prensagem isostática a quente? Um Guia para o Equipamento HIP Essencial
- Quanta energia consome a prensagem isostática a quente? Desbloqueie a Economia Líquida de Energia em Seu Processo
- Qual é a pressão da prensagem isostática a quente? Alcance Densidade Total e Desempenho Superior do Material
- Quais são algumas das propriedades atraentes dos produtos prensados isostaticamente a quente? Alcance Densidade Perfeita e Desempenho Superior
- Qual é o histórico do processo de Prensagem Isostática a Quente (HIP)? Das Raízes Nucleares ao Padrão Industrial



















