Critérios de conceção para células electrolíticas
Volume da célula electrolítica
O volume de uma célula electrolítica desempenha um papel fundamental na determinação da eficiência e precisão dos processos electroquímicos. O volume ideal da célula depende da manutenção de uma relação adequada entre o elétrodo de trabalho e o volume da solução. Este rácio não é estático; varia significativamente com base no tipo específico de medição ou teste que está a ser realizado.
Por exemplo, em medições analíticas de alta precisão, é frequentemente preferível um volume de célula mais pequeno com um rácio elétrodo-solução mais elevado. Esta configuração minimiza a espessura da camada de difusão, aumentando assim a sensibilidade e a exatidão das leituras. Por outro lado, em aplicações industriais em que está envolvida a produção de metais em grande escala, poderá ser necessário um volume de célula maior com uma relação elétrodo-solução mais baixa para acomodar o aumento do rendimento e as exigências operacionais.
| Tipo de medição | Volume de célula preferido | Relação elétrodo-solução |
|---|---|---|
| Análise de alta precisão | Pequena | Elevada (por exemplo, 1:10) |
| Produção industrial de metais | Grande | Baixa (por exemplo, 1:100) |
Compreender e otimizar este rácio é crucial para alcançar os resultados desejados em várias aplicações electroquímicas.
Material da célula electrolítica
Ao selecionar materiais para células electrolíticas, destacam-se duas opções principais: vidro e politetrafluoroetileno (PTFE). Cada material tem o seu próprio conjunto de vantagens e limitações, que devem ser cuidadosamente consideradas com base na aplicação específica e nas condições ambientais.
O PTFE, em particular, é conhecido pela sua excecional estabilidade, especialmente em ambientes agressivos, tais como alcalinos concentrados e água régia. Esta estabilidade é crucial para manter a integridade e a eficiência do processo eletrolítico, especialmente em ambientes industriais onde a exposição prolongada a substâncias corrosivas é inevitável. A natureza inerte do PTFE garante que não reage com o eletrólito ou outros componentes da célula, minimizando assim potenciais perturbações e prolongando o tempo de vida operacional da célula.
Por outro lado, o vidro oferece as suas próprias vantagens, particularmente em aplicações em que a transparência é essencial para monitorizar o processo eletrolítico. No entanto, a sua suscetibilidade à corrosão em ambientes fortemente alcalinos limita a sua utilização em determinados contextos. Apesar disso, o vidro continua a ser uma escolha popular para experiências à escala laboratorial e demonstrações educativas, devido à sua relação custo-eficácia e facilidade de fabrico.

Em resumo, a escolha entre vidro e PTFE depende dos requisitos específicos do processo eletrolítico, incluindo o ambiente químico, a longevidade operacional e considerações de custo.
Diafragma para célula electrolítica
O diafragma de uma célula electrolítica tem uma função crítica na separação do elétrodo de trabalho do elétrodo auxiliar. Um dos materiais mais utilizados para este fim é o vidro poroso. Esta escolha não é arbitrária; o vidro poroso oferece várias vantagens que melhoram o desempenho e a precisão do processo eletrolítico.
Em primeiro lugar, o vidro poroso assegura distribuição uniforme da corrente uniforme da corrente ao longo da célula. Esta uniformidade é essencial para manter medições consistentes e fiáveis. Ao proporcionar um caminho consistente para o fluxo de corrente, o vidro poroso ajuda a minimizar as flutuações e os erros nos dados recolhidos.
Em segundo lugar, a utilização do vidro poroso como diafragma reduz a interferência do elétrodo auxiliar. Nas células electrolíticas, os produtos gerados no elétrodo auxiliar podem por vezes difundir-se no ambiente do elétrodo de trabalho, causando reacções indesejadas e distorcendo os resultados. Os poros finos do vidro funcionam como uma barreira, impedindo essa contaminação cruzada e preservando a integridade do ambiente do elétrodo de trabalho.
Além disso, o vidro poroso é altamente resistente ao ataque químico tornando-o adequado para utilização numa variedade de soluções de electrólitos. Esta estabilidade química garante que o diafragma permanece eficaz durante longos períodos, mesmo em condições adversas.
Em suma, a seleção do vidro poroso como material de diafragma é motivada pela sua capacidade de proporcionar uma distribuição uniforme da corrente, reduzir as interferências e manter a estabilidade química, factores cruciais para o funcionamento preciso e fiável das células electrolíticas.
Eletrólito
Os electrólitos inertes desempenham um papel fundamental na conceção das células electrolíticas, principalmente para evitar a migração de substâncias activas que poderiam interferir com as reacções químicas pretendidas. A concentração destes electrólitos inertes deve ser significativamente mais elevada do que a das substâncias activas para garantir a sua eficácia. Normalmente, a concentração deve ser pelo menos 100 vezes superior à da substância ativa. Esta concentração elevada actua como uma barreira, minimizando o potencial de contaminação cruzada e assegurando a estabilidade e fiabilidade do processo eletrolítico.
Por exemplo, na produção industrial de metais, onde o controlo preciso das reacções químicas é crucial, a utilização de electrólitos inertes assegura que as reacções primárias não são comprometidas pela presença de outras espécies reactivas. Este rácio de concentração elevado não só estabiliza o ambiente eletrolítico como também aumenta a eficiência do processo, reduzindo a probabilidade de reacções secundárias indesejadas. Assim, a seleção cuidadosa e a gestão de electrólitos inertes são componentes essenciais na conceção e funcionamento das células electrolíticas.
Dispositivo de ventilação de células electrolíticas
Os canais de entrada e de saída são componentes essenciais de uma célula electrolítica, concebidos para facilitar os processos de desoxigenação e de adsorção de gases. A configuração destes canais é fundamental para manter a eficiência e a segurança do processo eletrolítico. Normalmente, a entrada é estrategicamente colocada no fundo da célula, assegurando que qualquer gás que entre é distribuído uniformemente pelo eletrólito. Esta colocação no fundo auxilia na mistura completa dos gases com o eletrólito, promovendo uma desoxigenação eficaz.
A saída, por outro lado, está equipada com um mecanismo de vedação de água. Este selo de água tem várias finalidades: evita o refluxo de gás da saída, assegura uma libertação controlada de gases e mantém uma pressão estável no interior da célula. Ao dispor de um selo de água, a célula electrolítica pode funcionar em condições óptimas, reduzindo o risco de fuga de gás e assegurando que o ambiente no interior da célula permanece estável e propício ao processo eletrolítico.
Em resumo, a conceção cuidadosa dos canais de entrada e saída, com a entrada na parte inferior e a saída com um selo de água, é crucial para a desoxigenação eficaz e a adsorção de gás nas células electrolíticas, melhorando assim a eficiência e a segurança globais do processo.
Ponte salina para célula electrolítica
A ponte salina é um componente essencial nas células electrolíticas, servindo como uma conduta que liga os eléctrodos de referência e de pesquisa. Esta ligação é crucial para manter a neutralidade eléctrica dentro da célula, facilitando assim o fluxo suave de iões e completando o circuito elétrico. A ponte salina é normalmente composta por um eletrólito forte, como o cloreto de sódio ou o nitrato de potássio, que está alojado num tubo de vidro em forma de U ou embebido em materiais porosos como o papel de filtro.
Uma das principais funções da ponte salina é atenuar o potencial de contacto do líquido, um fenómeno que ocorre quando dois electrólitos diferentes entram em contacto, conduzindo a uma diferença de potencial. Ao assegurar que a solução electrolítica na ponte salina é inerte e não reactiva com outras soluções, o risco de reacções químicas indesejadas é minimizado. Esta inércia permite o movimento desimpedido de iões entre as duas meias-células, mantendo uma distribuição de carga estável e evitando a contaminação.
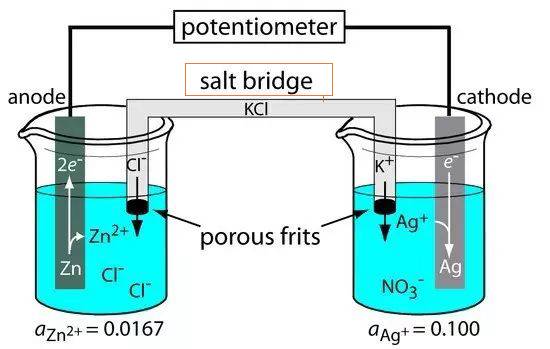
Existem dois tipos comuns de pontes salinas: a ponte de tubo de vidro e a ponte de papel de filtro. A ponte de tubo de vidro, como o nome sugere, é um tubo em forma de U cheio de electrólitos, enquanto a ponte de papel de filtro utiliza papel de filtro poroso embebido em soluções de electrólitos. Ambos os tipos têm o mesmo objetivo, mas diferem na sua estrutura física e facilidade de utilização.
Em aplicações práticas, como a construção de células galvânicas ou voltaicas, a ponte salina desempenha um papel fundamental. Quando os electrões passam de uma meia-célula para outra através de um circuito externo, estabelece-se uma diferença de carga. Sem a ponte salina, esta diferença de carga interromperia rapidamente o fluxo de electrões. A ponte salina permite o movimento contínuo de iões, assegurando que a distribuição de carga permanece estável e que a célula funciona eficientemente.
Em resumo, a ponte salina é um elemento crítico nas células electrolíticas, permitindo o fluxo contínuo de iões e mantendo a neutralidade eléctrica. A sua conceção e composição são cuidadosamente escolhidas para evitar reacções indesejadas e garantir a integridade do processo eletroquímico.
Tubo capilar Rukin para célula electrolítica
O tubo capilar Rukin desempenha um papel fundamental no design da célula electrolítica, particularmente na manutenção de uma resistência mínima entre os eléctrodos de referência e de trabalho. Esta caraterística crítica é essencial para obter um controlo preciso do potencial, que é fundamental para a precisão e fiabilidade dos processos electrolíticos.
Principais funções do tubo capilar Rukin
-
Resistência mínima: A principal função do tubo capilar Rukin é garantir que a resistência elétrica entre os eletrodos de referência e de trabalho seja mantida em um mínimo absoluto. Isto é conseguido através da conceção do tubo, que permite uma condutividade eléctrica eficiente sem perdas ou interferências significativas.
-
Controlo preciso do potencial: Ao facilitar a resistência mínima, o tubo capilar Rukin permite um controlo mais preciso da diferença de potencial entre os eléctrodos. Esta precisão é crucial para várias aplicações electrolíticas, desde a produção industrial de metais à investigação científica, onde mesmo pequenos desvios no potencial podem levar a erros significativos.
-
Estabilidade melhorada: O design do tubo capilar Rukin também contribui para a estabilidade geral da célula electrolítica. Ao reduzir a probabilidade de flutuações de potencial, ele ajuda a manter um ambiente consistente e estável para o processo eletrolítico.
Considerações sobre materiais e design
-
Seleção do material: O tubo capilar Rukin é normalmente feito de materiais que oferecem alta condutividade elétrica e resistência química, como platina ou ouro. Esses materiais garantem que o tubo possa suportar as condições adversas dos processos eletrolíticos sem degradação.
-
Geometria do tubo: A geometria do tubo capilar Rukin é cuidadosamente projetada para otimizar o fluxo de corrente elétrica. Isso inclui considerações sobre o comprimento do tubo, o diâmetro e a colocação dos canais de entrada e saída, que contribuem para minimizar a resistência e aumentar a condutividade.
Em resumo, o tubo capilar Rukin é um componente indispensável no projeto de células eletrolíticas, oferecendo uma solução robusta para garantir resistência mínima e controle preciso do potencial. A sua cuidadosa seleção de materiais e o seu design optimizado fazem dele um elemento-chave para obter resultados electrolíticos fiáveis e precisos.
Tipos de células electrolíticas
Célula electrolítica de câmara única
As células electrolíticas de câmara única são especificamente concebidas para estudos de corrosão, em que tanto os eléctrodos de investigação como os auxiliares estão alojados na mesma câmara. Esta configuração simplifica a instalação, eliminando a necessidade de compartimentação complexa, tornando-a uma escolha ideal para investigadores que se concentram nos mecanismos de corrosão.

Nestas células, a proximidade dos eléctrodos auxiliares e de investigação permite a monitorização em tempo real dos processos de corrosão. Isto é particularmente vantajoso em estudos onde se observam mudanças rápidas no potencial do elétrodo, uma vez que minimiza o intervalo de tempo entre as medições. Além disso, a conceção de câmara única reduz o risco de contaminação que poderia surgir de câmaras separadas, assegurando uma recolha de dados mais exacta e consistente.
Além disso, a utilização de uma única câmara facilita o controlo do ambiente eletrolítico. Os investigadores podem ajustar com precisão a composição e a concentração do eletrólito, bem como a temperatura e a pressão dentro da câmara, para simular várias condições de corrosão. Esta adaptabilidade é crucial para compreender como diferentes factores influenciam as taxas e padrões de corrosão.
Apesar das suas vantagens, a configuração de câmara única tem limitações. Por exemplo, a falta de um diafragma significa que não existe uma barreira física para separar os produtos do elétrodo de investigação dos do elétrodo auxiliar. Isto pode levar a potenciais interferências nas medições, particularmente em estudos que envolvam substâncias altamente reactivas ou voláteis. Por conseguinte, embora a conceção de câmara única seja prática para muitos estudos de corrosão, pode não ser adequada para todas as condições experimentais.
Célula electrolítica de câmara dupla
A célula electrolítica de câmara dupla foi concebida para atenuar a interferência dos produtos do elétrodo auxiliar, utilizando um diafragma que separa o elétrodo de trabalho do elétrodo auxiliar. Esta configuração é particularmente vantajosa para reduzir a contaminação cruzada e garantir medições mais precisas.

Principais caraterísticas e vantagens
- Material do diafragma: Tipicamente construído com vidro poroso, o diafragma permite a passagem de iões enquanto impede o contacto direto dos produtos do elétrodo, mantendo assim a integridade do ambiente de trabalho.
- Distribuição uniforme da corrente: O diafragma assegura uma distribuição uniforme da corrente através da célula electrolítica, o que é crucial para resultados consistentes e fiáveis.
- Interferência reduzida: Ao isolar o elétrodo de trabalho do elétrodo auxiliar, a conceção de câmara dupla reduz significativamente o potencial de interferência, aumentando a precisão dos dados recolhidos.
Aplicações e vantagens
- Estudos de corrosão: A configuração de câmara dupla é particularmente vantajosa em estudos de corrosão em que é essencial manter a pureza do elétrodo de trabalho.
- Medições de precisão: Para aplicações que requerem uma elevada precisão, como é o caso da química analítica, a célula de câmara dupla proporciona um ambiente controlado que minimiza as influências externas.
Esta conceção não só melhora a precisão das medições, como também prolonga a vida operacional dos eléctrodos, reduzindo a exposição a subprodutos potencialmente nocivos.
Tipos de eletrólise com base na produção de produtos
Tipo de eletrólise da água
A eletrólise da água é um processo fundamental que ocorre em condições específicas, envolvendo principalmente ácidos oxigenados , bases fortes e soluções de sais ácidos oxigenados de metais activos . Este tipo de eletrólise caracteriza-se pela decomposição das moléculas de água em gases de hidrogénio e oxigénio, uma reação que é simultaneamente intrigante do ponto de vista científico e significativa do ponto de vista industrial.
Para compreender a eletrólise da água, é essencial aprofundar a natureza dos electrólitos envolvidos. Ácidos oxigenados como o ácido nítrico (HNO₃) e o ácido sulfúrico (H₂SO₄), contêm átomos de oxigénio ligados ao átomo central, o que facilita a libertação de oxigénio durante o processo de eletrólise. Da mesma forma, bases fortes como o hidróxido de sódio (NaOH) e o hidróxido de potássio (KOH) proporcionam um ambiente altamente alcalino que promove a dissociação das moléculas de água.

No contexto de soluções de sais ácidos oxigenados de metais activos como o nitrato de sódio (NaNO₃) ou o sulfato de potássio (K₂SO₄), a presença de metais activos como o sódio (Na) ou o potássio (K) aumenta a condutividade da solução, facilitando assim o processo de eletrólise. Estes sais, quando dissolvidos em água, criam um meio condutor onde os metais activos actuam como portadores de carga, suportando o fluxo de electrões necessário para que a eletrólise ocorra.
A eletrólise da água não é apenas um processo fundamental em várias aplicações industriais, como a produção de hidrogénio gasoso para células de combustível, mas também serve como um conceito fundamental em eletroquímica. Compreender as condições específicas em que este processo ocorre - quer na presença de ácidos oxigenados, bases fortes ou soluções de sais ácidos oxigenados de metais activos - é crucial para otimizar a conceção de células electrolíticas e garantir uma conversão eficiente de energia.
Decomposição do tipo de eletrólito
A decomposição do tipo de eletrólito é um processo específico que ocorre em determinadas condições, particularmente com ácidos sem oxigénio e soluções que contêm metais inactivos e sais sem oxigénio. Este tipo de eletrólise distingue-se dos outros devido à ausência de oxigénio, que influencia significativamente as reacções químicas nos eléctrodos.
Em ambientes sem oxigénio, os ácidos e os sais não contribuem para a formação de gás oxigénio, que é um subproduto comum em muitos processos de eletrólise. Em vez disso, o foco está na interação direta entre o eletrólito e os eléctrodos, levando à decomposição do próprio eletrólito. Este processo é crucial em aplicações industriais onde a manutenção de um ambiente sem oxigénio é essencial para evitar a contaminação e garantir a pureza dos produtos finais.
Por exemplo, na produção de certos metais, a utilização de ácidos e sais sem oxigénio pode evitar a formação de óxidos que, de outra forma, poderiam comprometer a qualidade do metal. A ausência de oxigénio também simplifica as etapas de pós-processamento, uma vez que não há necessidade de remover do produto as impurezas à base de oxigénio.
Em resumo, a decomposição do tipo de eletrólito é caracterizada pela sua dependência de condições sem oxigénio, que não só alteram as vias químicas como também aumentam a eficiência e a pureza dos produtos resultantes.
Tipo alcalino de libertação de hidrogénio
O tipo de eletrólise alcalina de libertação de hidrogénio é um processo específico que ocorre na presença de metais activos e soluções ácidas anaeróbias. Este tipo de eletrólise é caracterizado pela libertação de hidrogénio gasoso no cátodo, que é o resultado direto da redução dos iões de hidrogénio presentes na solução ácida anaeróbia. Os metais activos, que são tipicamente metais alcalinos ou alcalino-terrosos, desempenham um papel crucial neste processo, fornecendo os electrões necessários para a reação de redução.
A natureza anaeróbia da solução ácida é essencial para evitar a formação de gás oxigénio, que de outra forma complicaria o processo de eletrólise. Num ambiente anaeróbico, os iões de hidrogénio são as principais espécies que sofrem redução, levando à produção eficiente de gás hidrogénio. Este processo é particularmente importante em aplicações industriais em que a produção de hidrogénio gasoso é um objetivo fundamental, como na produção de certos produtos químicos ou na tecnologia das pilhas de combustível.
Para facilitar este tipo de eletrólise, a célula electrolítica deve ser concebida com considerações específicas. A utilização de um diafragma, como o vidro poroso, é frequentemente utilizada para separar o elétrodo de trabalho do elétrodo auxiliar, assegurando uma distribuição uniforme da corrente e minimizando a interferência dos produtos do elétrodo auxiliar. Além disso, a concentração do eletrólito deve ser cuidadosamente controlada para evitar a migração de substâncias activas, o que poderia afetar negativamente o processo de eletrólise.
Em resumo, o tipo de eletrólise alcalina de libertação de hidrogénio é um processo especializado que aproveita a reatividade dos metais activos e as propriedades das soluções ácidas anaeróbias para produzir hidrogénio gasoso de forma eficiente. A conceção adequada da célula electrolítica e a seleção de materiais são fundamentais para garantir o sucesso deste processo em aplicações industriais.
Tipo de ácido gerador de oxigénio
O Tipo de ácido gerador de oxigénio de eletrólise é caracterizado pela sua ocorrência com soluções de oxigenados metálicos inactivos. Estas soluções, que incluem compostos como nitratos e sulfatos, são particularmente significativas em aplicações industriais onde a geração de oxigénio é um processo crítico.
Neste tipo de eletrólise, os metais inactivos, que não participam prontamente em reacções químicas, desempenham um papel crucial. Os oxigenados na solução actuam como a fonte primária de oxigénio, facilitando o processo eletrolítico. A estabilidade destes metais inactivos assegura que a célula electrolítica pode funcionar eficientemente sem o risco de contaminação ou de reacções não intencionais.
O processo envolve a decomposição dos oxigenados, levando à libertação de gás oxigénio no ânodo. Esta libertação é um resultado direto da ação electrolítica, em que a corrente eléctrica aplicada faz com que os oxigenados se decomponham nos seus elementos constituintes. Os metais inactivos permanecem praticamente inalterados, mantendo a integridade e a pureza do ambiente eletrolítico.
Os principais factores a considerar neste tipo de eletrólise incluem a concentração dos oxigenados na solução e a estabilidade dos metais inactivos. A concentração deve ser cuidadosamente controlada para garantir uma produção óptima de oxigénio, enquanto os metais devem ser escolhidos com base na sua inércia para evitar qualquer interferência no processo eletrolítico.
Em geral, o Tipo Ácido Gerador de Oxigénio de eletrólise é essencial em indústrias onde é necessário um controlo preciso da produção de oxigénio, como na refinação de metais e em certos processos de fabrico de produtos químicos.
Conversão de energia e condições de eletrólise
Caraterísticas do cátodo e do ânodo
Nos processos electrolíticos, os papéis do cátodo e do ânodo podem variar significativamente, dependendo da reação específica que ocorre na célula. Embora estes eléctrodos sejam componentes fundamentais da célula electrolítica, o seu envolvimento na reação química nem sempre é simples.
O cátodo, normalmente o local de redução, e o ânodo, onde ocorre a oxidação, não participam necessariamente de forma direta na reação. Isto significa que os próprios eléctrodos podem permanecer quimicamente inertes durante todo o processo, servindo apenas de condutas para o fluxo de electrões. Por exemplo, em algumas células electrolíticas, os eléctrodos são feitos de materiais como a platina ou a grafite, que são conhecidos pela sua estabilidade química e resistência à reação nas condições de eletrólise.
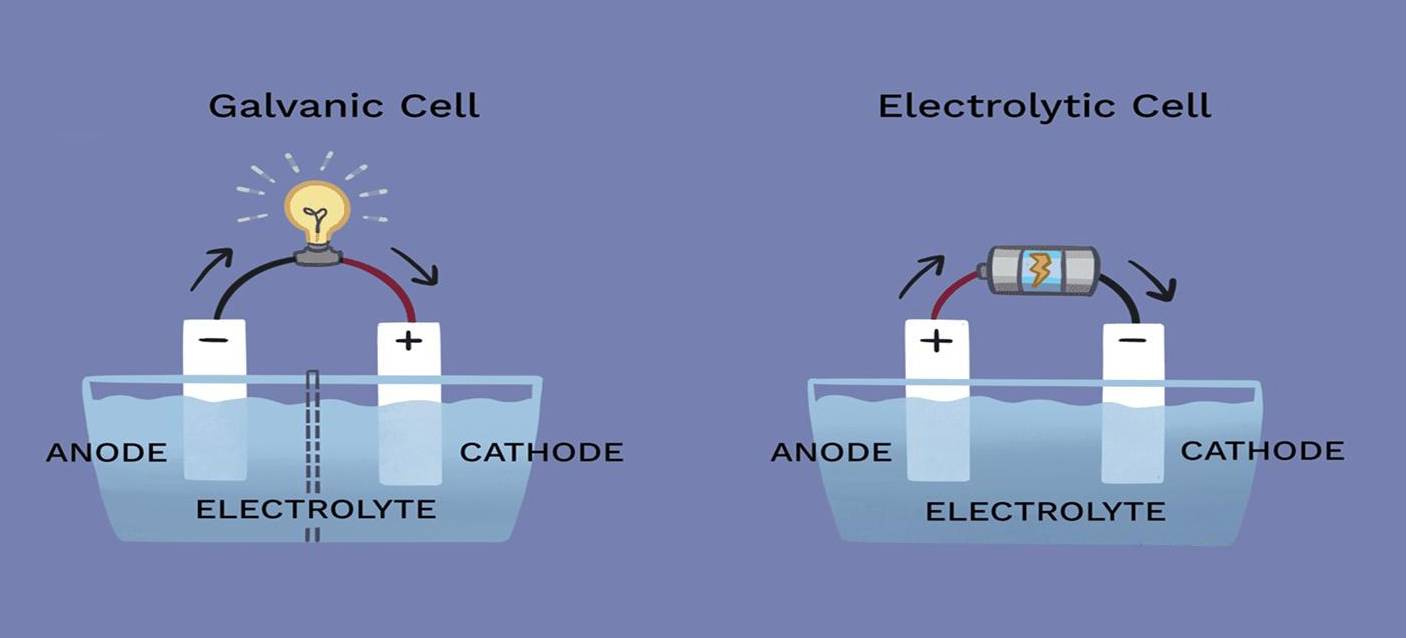
Além disso, a exigência de inércia não é universal. Em certas aplicações, são utilizados eléctrodos activos que podem sofrer alterações durante o processo. Estes eléctrodos activos podem influenciar a dinâmica da reação, alterando potencialmente a eficiência ou o resultado da eletrólise. Por conseguinte, a escolha entre eléctrodos inertes e activos é uma consideração de conceção crítica que tem impacto no desempenho geral e na eficácia da célula electrolítica.
Condições para a eletrólise
A eletrólise é um processo que exige condições específicas para funcionar eficazmente. Na sua essência, a eletrólise requer Fonte de alimentação de corrente contínua (DC) . Isto assegura um fluxo consistente de energia eléctrica, que é essencial para conduzir as reacções químicas nos eléctrodos.
A configuração envolve ligações distintas para o cátodo e ânodo . O cátodo, que atrai catiões, é normalmente ligado ao terminal negativo da fonte de alimentação CC, enquanto o ânodo, que atrai aniões, é ligado ao terminal positivo. Estas ligações são cruciais para a direção correta do fluxo de electrões e para as transformações químicas subsequentes.
Para que a eletrólise ocorra, os eléctrodos devem ser imersos numa solução electrolítica ou um eletrólito fundido . O eletrólito serve como meio através do qual os iões se podem mover, facilitando a condução da eletricidade. A escolha do eletrólito é fundamental, uma vez que este deve ser capaz de se dissociar em iões que possam participar nas reacções electroquímicas.
Por fim, um circuito fechado é necessário para completar o percurso elétrico. Isto assegura que os electrões podem fluir do ânodo para o cátodo através do circuito externo, enquanto os iões se movem através da solução electrolítica. Sem um circuito fechado, o fluxo de eletricidade seria interrompido e o processo de eletrólise cessaria.
Produtos relacionados
- Célula Eletrolítica Eletroquímica de Corrosão Plana
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
Artigos relacionados
- Técnicas avançadas de avaliação de revestimentos utilizando células electrolíticas
- Compreender a eletrodeposição com eléctrodos electroquímicos
- Técnicas avançadas de células electrolíticas para investigação de ponta em laboratório
- Aplicações das células electrolíticas na purificação e galvanoplastia
- Aplicações da célula electrolítica de tipo H na extração de metais














