Definição e função de um elétrodo
Índice
Descrição de um elétrodo
Um elétrodo é um ponto onde a corrente entra e sai do eletrólito. É um condutor utilizado para fazer uma junção com uma parte não metálica de um circuito. Os eléctrodos podem ser feitos de materiais como o ouro, a platina, o carbono, a grafite ou o metal. Servem de superfície para reacções de oxidação-redução em células electroquímicas. Existem diferentes tipos de eléctrodos, incluindo o ânodo e o cátodo.
Papel de um elétrodo numa célula eletroquímica
Os eléctrodos são componentes essenciais das células electroquímicas. Transportam os electrões produzidos na célula de uma meia-célula para outra, criando uma carga eléctrica. O cátodo é o elétrodo onde a corrente sai da célula, enquanto o ânodo é o elétrodo onde a corrente entra. O eletrólito na célula funciona como um canal para o fluxo de electrões entre o cátodo e o ânodo. O potencial da célula é calculado com base num sistema de eléctrodos padrão com um potencial de referência de 0 volts.

Diferença entre um ânodo e um cátodo
O ânodo e o cátodo têm papéis diferentes numa célula eletroquímica. Nas células electrolíticas, o cátodo tem carga negativa e neste elétrodo ocorre uma reação de redução. Os electrões deslocam-se para o cátodo durante o funcionamento da célula. Por outro lado, nas células electrolíticas, o ânodo tem uma carga positiva e neste elétrodo ocorre uma reação de oxidação. Os electrões saem do ânodo durante o funcionamento da célula. É importante notar que os papéis do ânodo e do cátodo podem mudar dependendo da direção do fluxo de electrões.
Em resumo, os eléctrodos são condutores utilizados nas células electroquímicas para facilitar a transferência de electrões. Desempenham um papel crucial no funcionamento destas células e são classificados como ânodos ou cátodos com base no tipo de reação química que ocorre. Compreender o papel e as funções dos eléctrodos é essencial no estudo da eletroquímica.
Mecânica de um elétrodo
Processo de oxidação e redução na superfície do elétrodo
Um elétrodo é uma superfície metálica onde se estabelece o equilíbrio de oxidação-redução entre o metal e a solução em que é colocado. O elétrodo pode ser um ânodo ou um cátodo.
-
Ânodo: O ânodo recebe a corrente ou os electrões da mistura electrolítica, provocando a sua oxidação. Quando os átomos ou moléculas se aproximam da superfície do ânodo, a solução doa electrões, resultando na formação de iões positivos.
-
Cátodo: O cátodo, por outro lado, liberta electrões para a solução, levando à redução.
Um elétrodo deve ser estável e resistir à corrosão, exceto nos casos em que o elétrodo é de sacrifício ou utilizado para processos específicos. A ação mecânica pode provocar a degradação dos eléctrodos, como a libertação de partículas de grafite, que podem exigir uma filtração. O inchaço do elétrodo também pode ser problemático em certos materiais.
Papel do ânodo e do cátodo nestes processos
Os ânodos e cátodos desempenham papéis cruciais em sistemas electroquímicos, tais como baterias, células de combustível, células fotovoltaicas, células electrolíticas e díodos.

-
Ânodo: O ânodo refere-se ao elétrodo onde ocorre a oxidação ou para onde fluem os electrões. É o terminal ou condutor onde os electrões deixam a célula eletroquímica, provocando a oxidação. Nas células primárias, o ânodo é fixo e não pode ser recarregado, enquanto que nas células secundárias, o ânodo pode mudar de polaridade dependendo da direção da corrente.
-
Cátodo: O cátodo refere-se ao elétrodo onde ocorre a redução ou para onde fluem os electrões. Os electrões entram na célula pelo cátodo e participam nas reacções de redução. Tal como o ânodo, o cátodo também pode mudar de polaridade nas células secundárias.
A corrosão nos eléctrodos pode ser grave, especialmente quando existem potenciais flutuantes no eletrólito ou quando são utilizados metais diferentes como ânodo e cátodo. No entanto, os inibidores e outros métodos preventivos podem ajudar a reduzir os ataques aos eléctrodos.
A eletrólise é um processo que ocorre em células electrolíticas, onde a energia eléctrica é utilizada para realizar reacções químicas não espontâneas. A oxidação ocorre no ânodo (placa positiva), enquanto a redução ocorre no cátodo (placa negativa).
Compreender a mecânica de um elétrodo, incluindo os processos de oxidação e redução, bem como os papéis do ânodo e do cátodo, é crucial em várias aplicações electroquímicas.
Composição do material de um elétrodo
Requisitos para um material de elétrodo
A eficiência das células electroquímicas é determinada pelas propriedades físicas dos eléctrodos. A composição do material de um elétrodo desempenha um papel crucial no seu desempenho. O principal requisito para um material de elétrodo é a condutividade. Qualquer material condutor, como metais, semicondutores, grafite ou polímeros condutores, pode ser utilizado como elétrodo. Em muitos casos, os eléctrodos são constituídos por uma combinação de materiais, cada um com uma função específica. Estes materiais incluem:
- Materiais activos: Estas são as partículas que sofrem oxidação ou redução no elétrodo.
- Agentes condutores: Melhoram a condutividade do elétrodo.
- Aglutinantes: São utilizados para conter as partículas activas no interior do elétrodo.
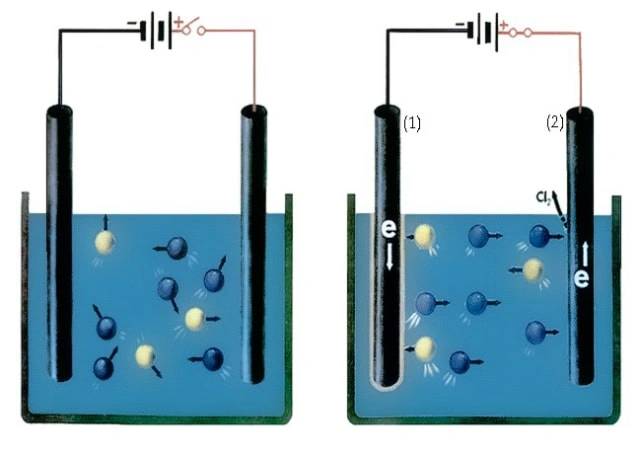
![Princípio da célula electrolítica (1.cátodo 2.ânodo)]()
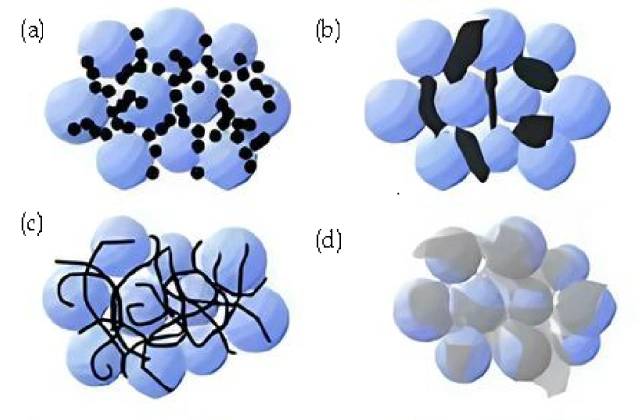
Resumo dos agentes condutores (a. Negro de fumo, nanopartículas rígidas; contacto ponto a ponto. b. Grafite condutora, partículas micrónicas rígidas; contacto ponto a ponto. c. Nanotubos de carbono, flexíveis; contacto de linha e ponto. d. Grafite, folha flexível; contacto de superfície e ponto. )
Para além da condutividade, outras propriedades importantes dos eléctrodos incluem a resistividade eléctrica, a capacidade térmica específica, o potencial do elétrodo e a dureza. O custo do material é também um fator importante a considerar nas aplicações tecnológicas.
Exemplos de eléctrodos inertes e reactivos
Um elétrodo pode ser inerte ou reativo, dependendo do seu envolvimento na reação de oxidação-redução (redox). Os eléctrodos inertes não participam na reação e são quimicamente não reactivos. Exemplos de eléctrodos inertes incluem a grafite (carbono), a platina, o ouro e o ródio. Estes materiais são utilizados quando o único objetivo do elétrodo é facilitar o fluxo de corrente na célula eletroquímica.
Por outro lado, os eléctrodos reactivos participam ativamente na reação redox. Sofrem oxidação ou redução juntamente com os reagentes. Por exemplo, um elétrodo de magnésio é um elétrodo ativo porque participa na reação. A escolha entre eléctrodos inertes e reactivos depende dos requisitos específicos do processo eletroquímico.
Papel do elétrodo na reação
O elétrodo serve de plataforma para a ocorrência da reação redox. Em alguns casos, as formas sólidas dos reagentes são utilizadas como eléctrodos. Por exemplo, numa célula eletroquímica de cobre-prata, o cobre e a prata são tanto os reagentes como os eléctrodos. Os eléctrodos reagentes facilitam a transferência de electrões e iões durante a reação redox.
Em alternativa, nas reacções que requerem um elétrodo inerte, é utilizado um metal que não participa na reação. Um exemplo disto é a platina na reação do elétrodo de hidrogénio padrão (SHE). O elétrodo inerte permite o fluxo de corrente sem interferir com a reação química.
A escolha do material do elétrodo é crucial para obter rendimentos e seletividade óptimos nos processos electroquímicos. As propriedades do material influenciam a cinética e a termodinâmica da transferência de electrões e podem determinar o sucesso ou o fracasso de uma transformação. Considerações como o custo, a estabilidade e a possibilidade de manipulação em várias formas também desempenham um papel importante na seleção do material de elétrodo adequado.
A composição do material e a estrutura interna de um elétrodo são factores essenciais que determinam o seu desempenho. A combinação de materiais activos, agentes condutores e aglutinantes numa pasta de eléctrodos aumenta a sua condutividade e funcionalidade. A mistura é então revestida sobre um condutor, que actua como coletor de corrente na célula eletroquímica.
Em resumo, a composição material de um elétrodo, quer seja inerte ou reativo, tem um impacto significativo na sua eficiência e funcionalidade em processos electroquímicos. A escolha do material do elétrodo deve basear-se nos requisitos específicos da aplicação, considerando factores como a condutividade, a estabilidade e o custo.
Exemplos de eléctrodos
Exemplos de eléctrodos inertes e reactivos normalmente utilizados
Pode ser feita a distinção entre eléctrodos activos e eléctrodos inertes. Por exemplo, um elétrodo de magnésio é normalmente um elétrodo ativo porque participa na reação de oxidação-redução (redox). Um elétrodo de platina é normalmente um elétrodo inerte porque não participa na reação de oxidação-redução. Um elétrodo inerte é quimicamente não reativo e só está presente para que a corrente possa fluir através da célula eletroquímica.
Exemplos de eléctrodos em química analítica
Exemplos de materiais típicos utilizados para eléctrodos em química analítica são o carbono amorfo, o ouro e a platina. Os eléctrodos de vidro são frequentemente utilizados em medições de pH; nesta aplicação, o vidro é quimicamente dopado para ser seletivo para iões de hidrogénio.
Exemplos de eléctrodos em pilhas
- As pilhas contêm uma variedade de eléctrodos, dependendo do tipo de pilha.
- As pilhas de chumbo-ácido são baseadas em eléctrodos de chumbo.
- As pilhas de zinco-carbono são feitas com eléctrodos de zinco e carbono amorfo.
![Células fotovoltaicas, células de combustível e díodos]()
As baterias de polímero de lítio têm eléctrodos feitos de uma matriz de polímero sólido dentro da qual os iões de lítio podem mover-se e atuar como portadores de carga.
Baterias de chumbo-ácido, baterias de zinco-carbono e baterias de polímero de lítio
- Exemplos de eléctrodos na eletrólise
- A energia eléctrica pode ser utilizada para converter sais e minérios em metais.
No processo Hall-Heroult para extrair alumínio metálico do óxido de alumínio, o ânodo e o cátodo são ambos feitos de grafite.
O sódio metálico é produzido por eletrólise utilizando um ânodo de carbono e um cátodo de ferro.
Eléctrodos inertes
Um metal que não interfere ou participa em quaisquer reacções químicas é conhecido como elétrodo inerte. No entanto, continua a ser utilizado para transferir eletricidade através da passagem de electrões através da solução, em vez da troca de iões.
Exemplos de eléctrodos inertes incluem a grafite, a platina, o ouro e o ródio.
Eléctrodos na análise quantitativa
Na análise potenciométrica, um elétrodo indicador responde a diferenças na atividade ou "concentração efectiva" da substância a analisar. Esta simplicidade torna a potenciometria uma técnica económica em comparação com a espetroscopia atómica ou a cromatografia iónica. Estes procedimentos podem ser classificados com base nos aspectos da célula que são controlados.

- Os eléctrodos são utilizados para fornecer corrente através de objectos não metálicos para os alterar de várias formas e para medir a condutividade para vários fins. Alguns exemplos incluem:
- Aplicações de eléctrodos (eléctrodos flexíveis de malha de nanofibras, placas bipolares de pilhas de células de combustível, EEG, etc.)
- Eléctrodos para células de combustível
- Eléctrodos para fins médicos, tais como EEG (para registo da atividade cerebral), ECG (registo dos batimentos cardíacos), ECT (estimulação eléctrica cerebral), desfibrilhador (registo e fornecimento de estimulação cardíaca)
- Eléctrodos para técnicas de eletrofisiologia em investigação biomédica
- Eléctrodos para a execução na cadeira eléctrica
- Eléctrodos para galvanoplastia
- Eléctrodos para soldadura por arco
- Eléctrodos para proteção catódica
- Eléctrodos para ligação à terra
- Eléctrodos para análises químicas por métodos electroquímicos
- Nanoelectrodos para medições de alta precisão em nanoelectroquímica
- Eléctrodos inertes para eletrólise (de platina)
Conjunto de eléctrodos de membrana
Eléctrodos para a arma de eletrochoque Taser
Elétrodo de hidrogénio padrão (SHE)
Definição e importância do SHE
Um elétrodo de hidrogénio padrão (SHE) é um elétrodo que os cientistas utilizam como referência para todas as reacções de potencial de meia célula. O valor do potencial do elétrodo padrão é zero, tornando-o a base para o cálculo dos potenciais celulares utilizando diferentes eléctrodos ou concentrações. Ter um elétrodo de referência comum como o SHE é crucial para medições e comparações precisas em experiências electroquímicas.
Composição do material e processo de reação do SHE
O SHE é composto por uma solução 1,0 M de H+(aq) que contém uma peça quadrada de platina platinada. A platina está ligada a um fio de platina, permitindo a troca de electrões. Dentro de um tubo de vidro, o hidrogénio gasoso passa para a solução, dando origem à seguinte reação

Este equilíbrio entre os iões de hidrogénio e o gás hidrogénio estabelece o potencial de referência da SHE.
Elétrodo de hidrogénio (1. Elétrodo de chumbo 2. Ponte salina 3. Elétrodo de platina negra platinada (a) Elétrodo de hidrogénio padrão)
Desafios na instalação e utilização da SHE
A instalação e a utilização da SHE podem apresentar alguns desafios. Um dos desafios é garantir a estabilidade do elétrodo de referência ao longo do tempo e com as mudanças de temperatura. Os componentes da SHE devem ser estáveis e fornecer potenciais de elétrodo fixos e reproduzíveis.
Outro desafio reside na construção do elétrodo de referência. A SHE é constituída por uma camisa de vidro com uma pequena entrada na parte superior e várias saídas na parte inferior. No interior da camisa de vidro, existe um tubo de vidro selado em ambas as extremidades, que contém o fio de platina platinada e uma placa de platina platinada na extremidade inferior. A camisa de vidro e o tubo são imersos num recipiente que contém uma solução de HCl 1 M. A construção correcta destes componentes é essencial para o funcionamento exato da SHE.
Em resumo, o elétrodo padrão de hidrogénio é uma ferramenta vital em eletroquímica, servindo de referência para medir e comparar potenciais de eléctrodos. A sua construção e utilização requerem uma atenção cuidadosa para garantir a estabilidade e a precisão das medições experimentais.
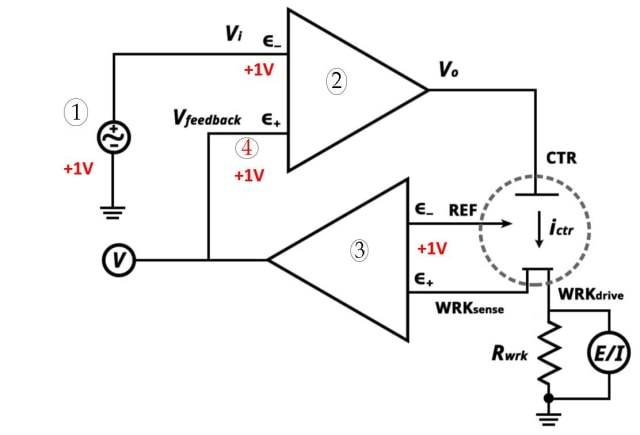
Sistema de três eléctrodos
O sistema de três eléctrodos é um componente essencial na voltametria. É constituído por três eléctrodos: o elétrodo de trabalho, o elétrodo de referência e o elétrodo auxiliar. Cada elétrodo desempenha um papel específico no sistema.
-
Descrição do sistema de três eléctrodosO sistema de três eléctrodos é utilizado em química electroanalítica para efetuar análises voltamétricas. Permite a medição e o controlo do fluxo de corrente numa célula eletroquímica. O sistema é constituído pelos eléctrodos seguintes:
-
Elétrodo de trabalho: O elétrodo de trabalho é responsável pelo transporte de electrões de e para as substâncias presentes na célula. Facilita as reacções electroquímicas que ocorrem durante a voltametria.
-
Elétrodo de referência: Um elétrodo de referência tem um potencial de elétrodo estabelecido. Pode ser utilizado como meia célula numa célula eletroquímica. Comparando o potencial do elétrodo de trabalho com o do elétrodo de referência, é possível determinar o potencial do elétrodo de trabalho.
![Aplicações de eléctrodos (eléctrodos flexíveis de malha de nanofibras, placas bipolares de pilhas de células de combustível, EEG, etc.)]()
Elétrodo auxiliar
: O elétrodo auxiliar garante que a corrente não passa através da célula de referência. Equilibra a corrente com a do elétrodo de trabalho. O elétrodo auxiliar é também conhecido como contra-elétrodo.
Sistema de três eléctrodos (1. Ponto de ajuste potenciostático 2. Amplificador operacional de alto ganho 3. Eletrómetro 4. Muito próximo)
-
Funções dos eléctrodos de trabalho, de referência e auxiliar
-
No sistema de três eléctrodos, cada elétrodo tem um papel específico a desempenhar:
-
O elétrodo de trabalho facilita as reacções electroquímicas através do transporte de electrões de e para as substâncias na célula.
O elétrodo de referência fornece um potencial de elétrodo conhecido contra o qual o potencial do elétrodo de trabalho pode ser medido. Funciona como um ponto de referência para determinar o potencial do elétrodo de trabalho.
O elétrodo auxiliar, também conhecido como contra-elétrodo, assegura que a corrente flui através da célula eletroquímica sem passar pelo elétrodo de referência. Equilibra a corrente com a do elétrodo de trabalho.
O sistema de três eléctrodos oferece vantagens distintas em relação às configurações de dois eléctrodos. Permite o isolamento do elétrodo de trabalho, possibilitando o estudo de reacções específicas com precisão e confiança. Esta configuração é normalmente utilizada em experiências electroquímicas.
As configurações de dois eléctrodos, por outro lado, são utilizadas nos casos em que a medição da tensão de toda a célula é significativa, como nos dispositivos electroquímicos de energia, como baterias, células de combustível e supercapacitores. Pode também ser utilizado quando se espera que o potencial do contra-elétrodo se mantenha estável durante toda a experiência.
Em geral, o sistema de três eléctrodos é uma ferramenta crucial na voltametria, permitindo a medição precisa e o controlo de reacções electroquímicas.
Exemplos de eléctrodos de referência

O elétrodo de calomelano é constituído por um tubo de vidro com uma arma lateral. No fundo do tubo, existe mercúrio puro com um fio de platina selado para as ligações eléctricas. Por cima do mercúrio, existe uma pasta de cloreto de mercúrio (calomelano) em mercúrio. O resto do tubo é preenchido com uma solução saturada de KCl. A arma lateral serve para mergulhar o tubo em qualquer solução utilizada para acoplar o elétrodo de calomelano.
- elétrodo de calomelano
- Funcionamento: O elétrodo de calomelano pode atuar como elétrodo negativo, sendo possíveis duas reacções em função da natureza do outro elétrodo ao qual está acoplado. Quando actua como elétrodo negativo, ocorrem as seguintes reacções
2 Hg(l) → 2 Hg+ + 2 e-
2 Hg+ + 2 Cl- → Hg2Cl2(s)
- A reação de oxidação líquida é a formação de cloreto de mercúrio.
- Vantagens do elétrodo de calomelano
- Relativamente mais fácil de fabricar e manter do que o elétrodo de hidrogénio padrão (SHE)
- Composto por pasta sólida e mercúrio líquido, o que o torna conveniente de utilizar
Não necessita de uma ponte salina separada, uma vez que já contém um tubo lateral com solução de KCl
- O potencial não se altera sensivelmente com o tempo e com ligeiras mudanças de temperatura
- Desvantagens do elétrodo de calomelano:
- É necessário compensar o potencial quando se medem os potenciais de meia célula
Não pode ser utilizado na medição de potenciais em que os iões K+ e Cl- interferem
O potencial de oxidação depende da concentração de KCl, pelo que alterações na concentração podem afetar o potencial do elétrodo.

O elétrodo de cloreto de prata-prata é muito utilizado como elétrodo de referência devido ao seu preço acessível e à sua menor toxicidade em comparação com o elétrodo de Calomel. Este elétrodo é constituído por prata sólida e pelo seu sal precipitado, AgCl. É fabricado revestindo um fio de prata sólida com AgCl e mergulhando-o num tubo de solução de KCl e AgCl.
Elétrodo de cloreto de prata e prata
- Funcionamento: O elétrodo de cloreto de prata-prata permite a formação de iões e o fluxo de electrões para dentro e para fora do sistema de eléctrodos. Pode atuar como elétrodo de referência quando acoplado a outro elétrodo.
- Vantagens do elétrodo de cloreto de prata e prata:
- Barato e amplamente disponível
- Menos tóxico do que o elétrodo de calomelano
- Fácil de montar e reproduzir
- Prático e fácil de transportar
- Compacto e de dimensões reduzidas, requerendo pouco espaço
Não é necessária uma ponte salina separada, uma vez que já contém um tubo lateral com solução de KClO potencial permanece relativamente estável ao longo do tempo e com ligeiras alterações de temperaturaEléctrodos de
Produtos relacionados
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Eletrodo de Chapa de Platina para Aplicações Laboratoriais e Industriais
- Célula Eletrolítica Eletroquímica de Corrosão Plana
- Eletrodo de Ouro Eletroquímico em Folha de Ouro
Artigos relacionados
- O Paradoxo da Transparência: Dominando a Frágil Arte das Células Eletrolíticas
- Técnicas avançadas de avaliação de revestimentos utilizando células electrolíticas
- O Frágil Recipiente da Verdade: Um Manifesto de Manutenção para Células Eletrolíticas
- A Arquitetura da Precisão: Por Que os Detalhes Invisíveis Definem o Sucesso Eletroquímico
- Técnicas avançadas de células electrolíticas para investigação de ponta em laboratório