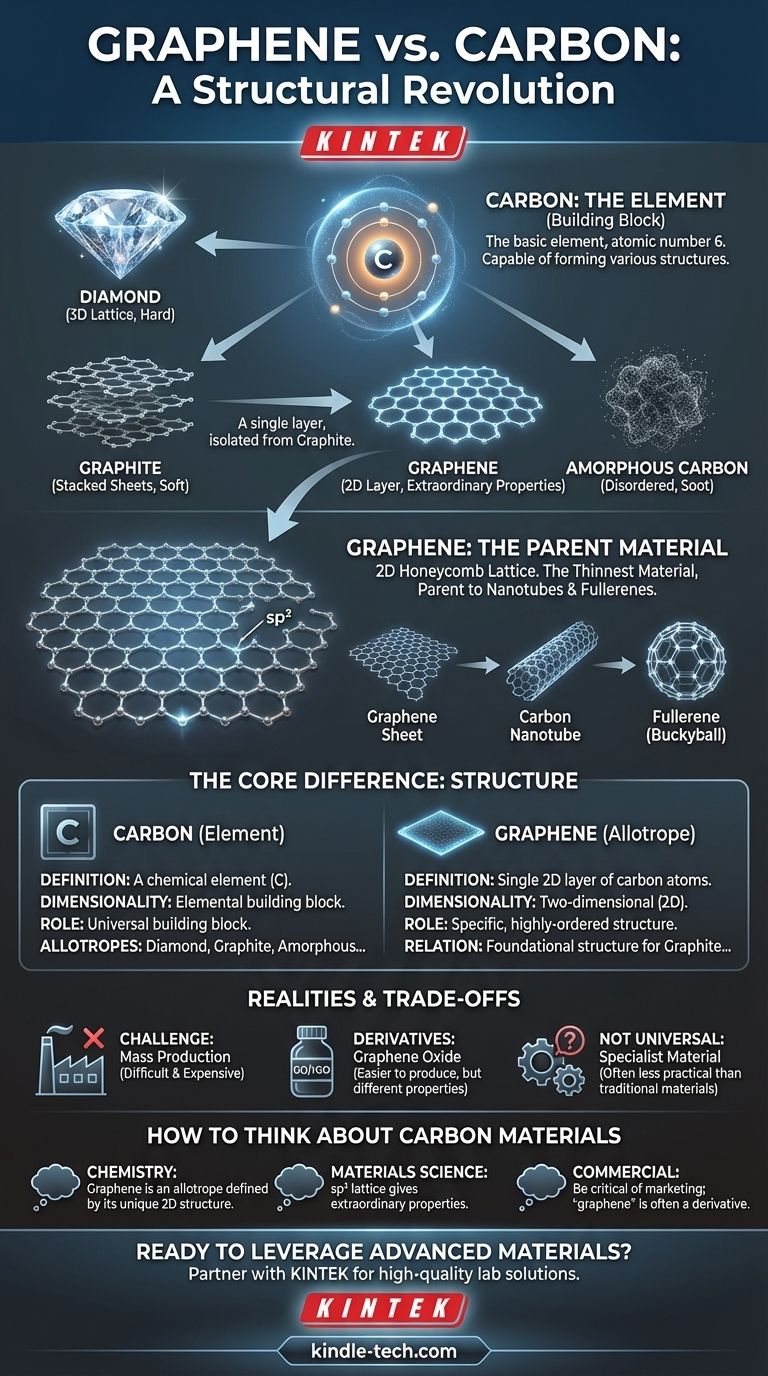
A diferença fundamental não é de substância, mas de estrutura. O grafeno não é um material diferente do carbono; é uma forma específica e bidimensional do elemento carbono. Enquanto o carbono é o elemento básico, o grafeno é uma camada única, com a espessura de um átomo, de átomos de carbono dispostos em uma rede precisa em favo de mel, e é esse arranjo exclusivo a fonte de todas as suas propriedades extraordinárias.
A distinção central a lembrar é que "carbono" é o elemento — o bloco de construção — enquanto "grafeno" é uma estrutura específica e altamente ordenada construída exclusivamente a partir desses blocos. Pense nisso como diamante e grafite: ambos são carbono puro, mas seus diferentes arranjos atômicos lhes conferem propriedades vastamente diferentes.

Do Elemento ao Alótropo: A Fundação do Carbono
Para compreender o papel do grafeno, devemos primeiro entender a versatilidade de seu elemento de origem, o carbono. Este contexto é essencial para apreciar por que uma simples mudança estrutural pode criar um material revolucionário.
Carbono: O Bloco de Construção Universal
O carbono é um elemento (número atômico 6) encontrado na tabela periódica. Sua característica definidora é a capacidade de formar fortes ligações covalentes consigo mesmo e com muitos outros elementos, criando um vasto número de compostos.
Em sua forma elementar, o carbono pode existir em várias configurações estruturais diferentes.
O Conceito de Alótropos
Essas diferentes formas estruturais de um único elemento são chamadas de alótropos. Os átomos são idênticos, mas seu arranjo no espaço é diferente, levando a propriedades físicas e químicas drasticamente diferentes.
O exemplo clássico é a relação entre o grafite macio e cinza usado em lápis e o diamante duro e transparente usado em joias. Ambos são carbono puro, mas suas propriedades divergem inteiramente devido à sua estrutura atômica.
Alótropos Comuns do Carbono
O grafeno é apenas um dos vários alótropos de carbono importantes. Os principais incluem:
- Diamante: Os átomos de carbono são dispostos em uma rede tetraédrica rígida e tridimensional. Isso o torna incrivelmente duro.
- Grafite: Os átomos de carbono são dispostos em folhas de uma rede hexagonal, que são empilhadas umas sobre as outras. Essas camadas podem deslizar facilmente, tornando o grafite macio.
- Grafeno: Uma única camada isolada da rede hexagonal que compõe o grafite.
- Carbono Amorfo: Uma forma, como fuligem ou carvão, onde os átomos de carbono não têm ordem cristalina de longo alcance.
O Que Torna o Grafeno uma Forma Única de Carbono?
A fama do grafeno vem de ser a expressão mais pura do potencial bidimensional do carbono. É a estrutura fundamental para outros alótropos.
Um Material Verdadeiramente Bidimensional
A característica definidora do grafeno é que ele é uma camada atômica única. Com apenas um átomo de espessura, é o material mais fino já criado, um verdadeiro plano 2D de átomos.
A Rede em Favo de Mel
Os átomos de carbono no grafeno são ligados por ligações sp², formando um padrão hexagonal perfeitamente repetitivo, muito parecido com um favo de mel ou tela de galinheiro. Essa estrutura plana e rigidamente ligada é a fonte de sua notável estabilidade e resistência.
O Pai de Outros Materiais
Entender o grafeno esclarece sua relação com outras formas de carbono. Você pode pensar no grafite como simplesmente uma pilha de inúmeras folhas de grafeno. Além disso, você pode enrolar conceitualmente uma folha de grafeno em um tubo para formar um nanotubo de carbono ou enrolá-la em uma esfera para formar um fulereno (buckyball).
Compreendendo as Compensações e Realidades Práticas
Embora as propriedades do grafeno sejam extraordinárias, sua aplicação no mundo real é restringida por desafios práticos significativos. Reconhecer essas limitações é fundamental para uma compreensão objetiva.
O Desafio da Produção em Massa
Produzir folhas grandes e sem defeitos de grafeno puro é extremamente difícil e caro. O famoso "método da fita adesiva" usado em sua descoberta (descascando camadas do grafite) não é escalável para uso industrial.
"Grafeno" vs. Derivados de Grafeno
Muitos produtos comercializados como contendo "grafeno" na verdade usam materiais relacionados, como óxido de grafeno (GO) ou óxido de grafeno reduzido (rGO). Estes são mais fáceis e baratos de produzir em massa, mas possuem propriedades elétricas e mecânicas diferentes e frequentemente inferiores em comparação com o grafeno puro.
Não é uma Solução Universal
O grafeno é um material especializado. Embora seja mais forte que o aço e mais condutor que o cobre, seu custo e dificuldades de integração fazem com que os materiais tradicionais permaneçam mais práticos e econômicos para a grande maioria das aplicações.
Como Pensar Sobre Materiais de Carbono
Sua perspectiva sobre a relação carbono-grafeno depende do seu objetivo. Use estes pontos para enquadrar seu pensamento.
- Se seu foco principal for química fundamental: Lembre-se de que o grafeno é um alótropo do elemento carbono, definido por sua estrutura única de favo de mel 2D.
- Se seu foco principal for ciência dos materiais: Concentre-se em como a rede ligada por
sp²do grafeno dá origem a propriedades extraordinárias — resistência, condutividade e leveza — que são fundamentalmente diferentes dos alótropos 3D, como o diamante. - Se seu foco principal forem produtos comerciais: Seja crítico em relação às alegações de marketing e entenda que o "grafeno" usado é frequentemente um derivado, onde o desafio reside em alcançar uma produção econômica em escala.
Em última análise, reconhecer a diferença entre carbono, o elemento, e grafeno, a estrutura, é a chave para entender uma nova classe de materiais projetados no nível atômico.
Tabela de Resumo:
| Característica | Carbono (Elemento) | Grafeno (Alótropo) |
|---|---|---|
| Definição | Um elemento químico (C) | Uma única camada de átomos de carbono em uma rede em favo de mel 2D |
| Dimensionalidade | N/A (Bloco de construção elementar) | Bidimensional (2D) |
| Alótropos Principais | Diamante, Grafite, Carbono Amorfo | A estrutura fundamental para Grafite, Nanotubos de Carbono |
| Distinção Principal | O bloco de construção universal | Uma estrutura específica e altamente ordenada feita de átomos de carbono |
Pronto para alavancar materiais avançados em sua pesquisa?
Compreender as nuances de materiais como o grafeno é fundamental para a inovação. Na KINTEK, nos especializamos em fornecer os equipamentos de laboratório e consumíveis de alta qualidade que você precisa para expandir os limites da ciência dos materiais. Se você está trabalhando com alótropos de carbono ou outros materiais avançados, nossos produtos apoiam precisão, confiabilidade e descoberta.
Deixe a KINTEK ser sua parceira em pesquisa. Entre em contato com nossos especialistas hoje mesmo para encontrar as soluções perfeitas para os desafios exclusivos do seu laboratório.
Guia Visual
Produtos relacionados
- Misturador Orbital de Laboratório Multifuncional de Rotação e Oscilação
- Moedor Híbrido de Tecidos Laboratorial
- Homogeneizador de Alto Cisalhamento para Aplicações Farmacêuticas e Cosméticas
- Fabricante Personalizado de Peças de PTFE Teflon para Peneira de Malha F4 de PTFE
- Máquina Automática de Prensagem a Quente de Laboratório
As pessoas também perguntam
- Quais materiais são necessários para filmes finos? Metais, Óxidos e Semicondutores para Sua Aplicação
- Qual a temperatura máxima que os nanotubos de carbono no ar conseguem suportar? Compreendendo o Limite de Oxidação
- Qual é a síntese de grafeno por deposição química de vapor? Produção Escalável de Filmes de Alta Qualidade
- Como ocorre a formação do plasma por pulverização catódica (sputtering)? Um guia para gerar e controlar o plasma de pulverização catódica
- Quais são as vantagens da pulverização catódica sobre a evaporação? Obtenha Qualidade e Desempenho Superiores do Filme
- O que é deposição de filmes finos de metais? Aprimore seu substrato com revestimentos metálicos avançados
- O que é um alvo de pulverização catódica para semicondutores? A Fonte Engenheirada para Filmes Finos de Alta Pureza
- Qual é a unidade da taxa de deposição? Dominando o Controle de Filmes Finos para Fabricação de Precisão



















