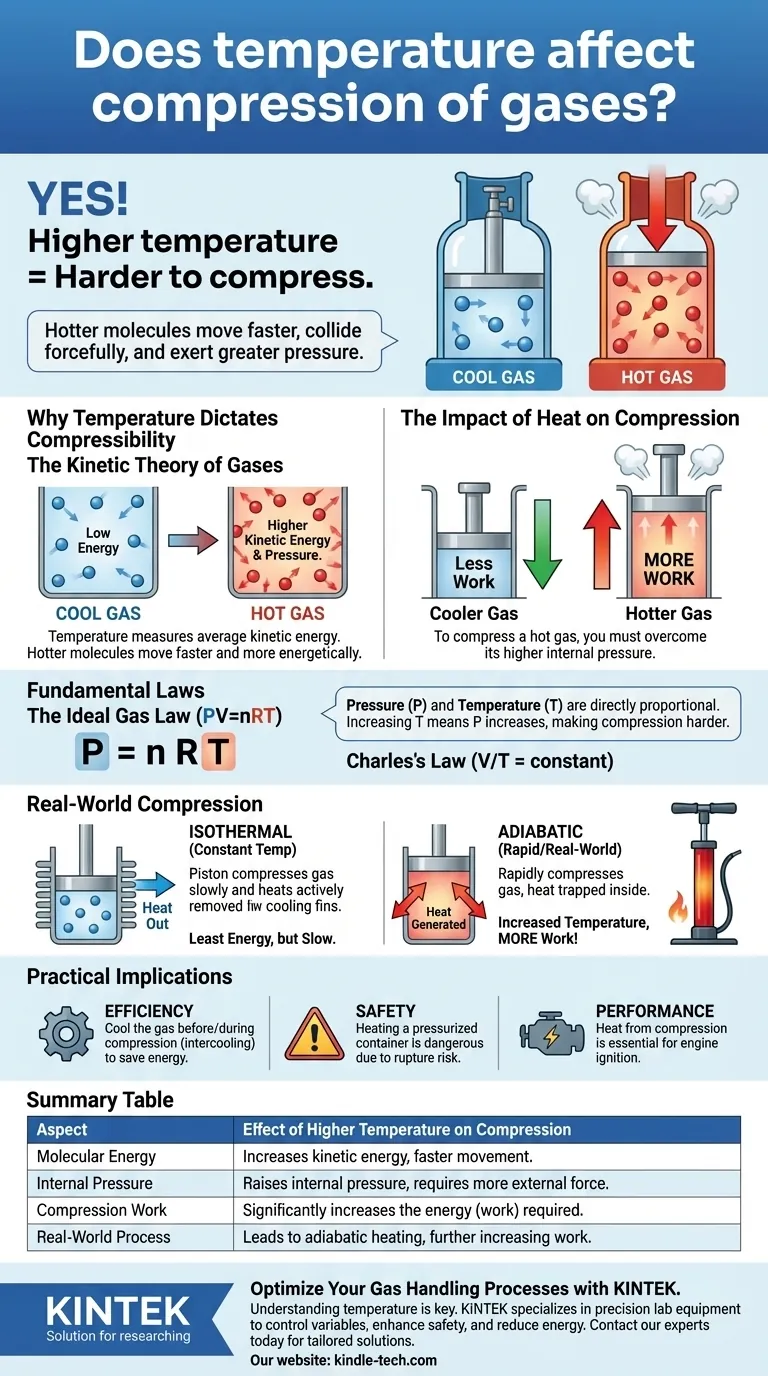
Sim, a temperatura tem um efeito direto e crítico na compressão dos gases. Um gás a uma temperatura mais alta é significativamente mais difícil de comprimir do que o mesmo gás a uma temperatura mais baixa. Isso ocorre porque a temperatura é uma medida da energia cinética das moléculas do gás; moléculas mais quentes movem-se mais rapidamente, colidem com mais força contra as paredes de seu recipiente e, portanto, exercem uma pressão maior que deve ser superada.
O princípio central é que comprimir um gás requer trabalho para superar a pressão exercida por suas moléculas. Como um gás mais quente exerce mais pressão em um determinado volume, ele requer mais trabalho para ser comprimido.

Por Que a Temperatura Determina a Compressibilidade
Para entender a relação entre temperatura e compressão, devemos observar o comportamento das moléculas de gás. Isso é explicado pela teoria cinética dos gases.
A Teoria Cinética dos Gases
Temperatura é uma medição macroscópica da energia cinética média das moléculas em uma substância. Temperaturas mais altas significam que as moléculas de gás individuais estão se movendo mais rápido e com mais energia.
Um gás frio tem moléculas com menor energia cinética média, o que significa que se movem mais lentamente. Um gás quente tem moléculas com maior energia cinética média, fazendo com que se movam muito mais rápido.
Pressão Como Resultado de Colisões Moleculares
A pressão que um gás exerce é o resultado de inúmeras moléculas colidindo com as paredes de seu recipiente. Cada colisão imprime uma pequena quantidade de força.
Quando as moléculas estão mais quentes e se movendo mais rápido, elas atingem as paredes do recipiente com mais frequência e com maior força, resultando em pressão mais alta.
O Impacto do Calor na Compressão
Comprimir um gás significa forçar suas moléculas para um volume menor. Para fazer isso, você deve aplicar uma pressão externa que seja maior do que a pressão interna do gás.
Como um gás quente exerce naturalmente uma pressão interna maior, você deve aplicar uma força externa significativamente maior para comprimi-lo ao mesmo volume que um gás mais frio.
As Leis Fundamentais em Ação
Essa relação não é apenas teórica; ela é precisamente descrita por leis fundamentais dos gases que formam a base da termodinâmica.
A Lei dos Gases Ideais (PV=nRT)
A Lei dos Gases Ideais é a equação unificadora: Pressão (P) × Volume (V) = número de mols de gás (n) × constante do gás (R) × Temperatura (T).
Esta equação mostra que pressão e temperatura são diretamente proporcionais. Se você mantiver o volume constante e aumentar a temperatura (T), a pressão (P) também deverá aumentar. Isso confirma por que um gás mais quente é mais difícil de comprimir — ele começa em uma pressão mais alta ou constrói uma pressão mais alta.
Lei de Charles (V/T = constante)
A Lei de Charles afirma que, para uma quantidade fixa de gás a pressão constante, o volume é diretamente proporcional à sua temperatura absoluta.
Embora isso descreva a expansão ao aquecer, seu inverso é igualmente verdadeiro para a compressão. Para manter uma pressão constante enquanto se reduz o volume, seria necessário reduzir proporcionalmente a temperatura.
Realidades Práticas e Trocas Críticas
Em aplicações do mundo real, o processo de compressão em si introduz uma complicação crítica: o calor.
O Caso Idealizado: Compressão Isotérmica
A compressão isotérmica pressupõe que a temperatura do gás é mantida perfeitamente constante durante todo o processo.
Para conseguir isso, você precisaria remover ativa e continuamente o calor que é gerado pelo ato da compressão. Este processo requer a menor quantidade de energia (trabalho), mas é frequentemente lento e impraticável.
O Caso do Mundo Real: Compressão Adiabática
Em quase todos os cenários de compressão rápida, como em um cilindro de motor ou uma bomba de bicicleta, o processo é mais próximo do adiabático. Isso significa que nenhum calor é permitido escapar do sistema.
Toda a energia que você coloca na compressão do gás aumenta sua energia interna, causando um aumento rápido e significativo da temperatura. É por isso que uma bomba de pneu esquenta durante o uso.
A Consequência: Aumento do Trabalho Necessário
Esse aquecimento adiabático trabalha contra você. À medida que você comprime o gás, sua temperatura aumenta, o que, por sua vez, aumenta ainda mais sua pressão interna.
Você agora está lutando contra uma força de oposição em contínua expansão. É por isso que a compressão no mundo real sempre requer mais trabalho do que o ideal teórico de temperatura constante. Compressores de múltiplos estágios com resfriadores intermediários são usados na indústria especificamente para combater esse efeito.
Fazendo a Escolha Certa para o Seu Objetivo
Compreender essa relação é crucial para a eficiência, segurança e desempenho em qualquer sistema que envolva gases comprimidos.
- Se o seu foco principal for eficiência industrial: Resfriar o gás antes e durante a compressão (um processo conhecido como resfriamento intermediário) reduzirá drasticamente a energia necessária para comprimi-lo.
- Se o seu foco principal for segurança: Reconheça que aquecer um recipiente selado e pressurizado é extremamente perigoso porque a pressão interna aumentará proporcionalmente à temperatura, criando risco de ruptura.
- Se o seu foco principal for desempenho do motor: O calor gerado durante o curso de compressão de um motor de combustão interna é essencial para inflamar a mistura ar-combustível, convertendo essa energia térmica em trabalho mecânico.
Em última análise, a temperatura não é uma variável passiva, mas uma participante ativa no trabalho de comprimir um gás.
Tabela de Resumo:
| Aspecto | Efeito da Temperatura Mais Alta na Compressão |
|---|---|
| Energia Molecular | Aumenta a energia cinética, fazendo as moléculas se moverem mais rápido. |
| Pressão Interna | Aumenta a pressão interna do gás, exigindo mais força externa para comprimir. |
| Trabalho de Compressão | Aumenta significativamente a energia (trabalho) necessária para a compressão. |
| Processo do Mundo Real | Leva ao aquecimento adiabático, aumentando ainda mais a resistência e o trabalho necessário. |
Otimize Seus Processos de Manuseio de Gases com a KINTEK
Compreender a relação crítica entre temperatura e compressão de gases é fundamental para a eficiência, segurança e desempenho em qualquer ambiente de laboratório ou industrial. Quer você esteja projetando um novo sistema ou otimizando um existente, gerenciar os efeitos térmicos é fundamental.
A KINTEK é especializada em equipamentos de laboratório de precisão e consumíveis que ajudam você a controlar essas variáveis. Desde ambientes com temperatura controlada até sistemas de compressão eficientes, nossas soluções são projetadas para aprimorar a segurança do seu fluxo de trabalho e reduzir o consumo de energia.
Deixe-nos ajudá-lo a obter resultados superiores. Entre em contato com nossos especialistas hoje mesmo através do nosso formulário de contato para discutir como nossas soluções personalizadas podem atender às suas necessidades e desafios específicos de laboratório.
Guia Visual
Produtos relacionados
- Fabricante Personalizado de Peças de PTFE Teflon para Aplicações de Válvulas de Ar
- Molde de Prensa de Bolas para Laboratório
- Máquina Manual de Prensa Hidráulica Aquecida com Placas Aquecidas para Prensa a Quente de Laboratório
- Molde de Prensagem Poligonal para Laboratório
- Máquina Automática de Prensagem a Quente de Laboratório
As pessoas também perguntam
- Por que são necessários béqueres de PTFE para a validação de ICP-OES de metal de háfnio? Garanta a dissolução pura da amostra
- Por que um Molde de PTFE é Selecionado para Preparar Filmes Compostos? Garanta Resultados Puros e Sem Danos
- Qual é a função dos anéis de vedação de PTFE na hidrólise ácida de celulose? Garante a vedação estanque do reator a 250°C
- Por que o politetrafluoroetileno (PTFE) é preferido como material de revestimento para reatores? Garanta a Máxima Resistência Química
- Quais são os quatro tipos principais de sensores? Um guia sobre fonte de alimentação e tipo de sinal



















