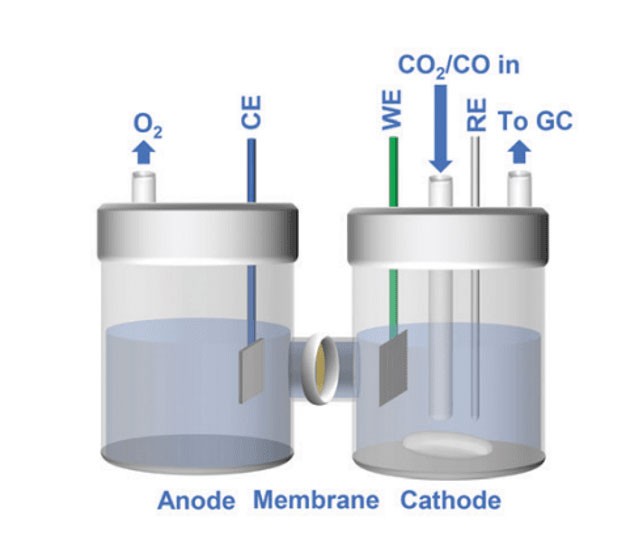
Introdução às células electrolíticas de quartzo
As células electrolíticas de quartzo são fundamentais na transformação de energia eléctrica em energia química, desempenhando um papel crucial em vários processos industriais. Estas células caracterizam-se pela utilização do quartzo como material chave, que não só resiste a altas temperaturas como também mantém a inércia química. No seu núcleo, as células electrolíticas de quartzo consistem em eléctrodos e electrólitos, que juntos facilitam reacções precisas de oxidação e redução. Esta introdução prepara o terreno para uma exploração mais profunda dos mecanismos, aplicações e vantagens das células electrolíticas de quartzo, destacando a sua importância em indústrias que vão desde a produção de metais à farmacêutica.
Mecanismo de ação das células electrolíticas de quartzo
As células electrolíticas de quartzo são dispositivos especializados utilizados em vários processos industriais, particularmente na electrorefinação e electrolavagem de metais não ferrosos como o alumínio, cobre, zinco e chumbo. Estas células são concebidas para facilitar a migração de iões e a condução eficiente de reacções de oxidação e redução através da utilização de uma estrutura de quartzo e de um meio eletrolítico cuidadosamente escolhido.
Migração de iões e funções dos eléctrodos
Numa célula electrolítica de quartzo, o processo inicia-se quando é aplicada uma tensão externa ao sistema. Esta tensão impulsiona a migração de iões dentro do eletrólito. Os iões positivos, ou catiões, são atraídos para o cátodo carregado negativamente, enquanto os iões negativos, ou aniões, se movem em direção ao ânodo carregado positivamente. Este movimento dos iões é crucial para a condução da eletricidade e para o início das reacções químicas.
No cátodo, ocorrem reacções de redução. Aqui, os catiões ganham electrões e são depositados na superfície do cátodo. Por exemplo, na electrorefinação do cobre, os iões de cobre (Cu²⁺) ganham electrões para formar cobre metálico puro, que é depois depositado no cátodo. Este processo é essencial para obter metais de elevada pureza utilizados em várias aplicações industriais.
No ânodo, pelo contrário, ocorrem reacções de oxidação. Os aniões perdem electrões e libertam outros iões ou moléculas. No caso da electrorefinação do cobre, o ânodo é constituído por cobre impuro. À medida que o cobre se dissolve, liberta impurezas para o eletrólito, que são depois removidas, deixando para trás cobre puro no cátodo.

Importância do meio eletrolítico
O meio eletrolítico numa célula electrolítica de quartzo desempenha um papel fundamental na eficiência e eficácia das reacções. O eletrólito deve ser um bom condutor de iões e deve ser estável sob as condições da reação. Os electrólitos comuns incluem soluções aquosas de sais, ácidos ou bases, bem como sais fundidos.
A escolha do eletrólito depende dos requisitos específicos da reação, tais como o pH desejado, a concentração de iões e a temperatura a que a reação ocorre. Por exemplo, na produção de alumínio de alta pureza, é utilizada como eletrólito uma mistura fundida de criolite (Na₃AlF₆) e alumina (Al₂O₃). Esta mistura tem um baixo ponto de fusão e é altamente condutora, tornando-a ideal para a redução eletrolítica de alumina em alumínio.
Estrutura do Quartzo e suas Vantagens
A utilização de quartzo em células electrolíticas oferece várias vantagens. O quartzo é um excelente isolante, o que ajuda a manter a integridade do campo elétrico dentro da célula. Para além disso, o quartzo é resistente à corrosão química, garantindo que a célula pode funcionar em condições adversas sem se degradar.
A estrutura de quartzo também permite um controlo preciso da distribuição dos iões e do fluxo de eletricidade. Esta precisão é crucial para otimizar a eficiência das reacções e minimizar as perdas de energia. Além disso, a transparência do quartzo permite a monitorização visual das reacções, o que é benéfico para o controlo do processo e a resolução de problemas.
Aplicações na purificação de metais e galvanoplastia
As células electrolíticas de quartzo são amplamente utilizadas na purificação de metais e em processos de galvanoplastia. Na purificação de metais, como a electrorefinação do cobre, o metal impuro é utilizado como ânodo e um metal puro é depositado no cátodo. Este processo remove as impurezas e resulta num metal de elevada pureza, adequado para várias aplicações industriais.
Na galvanoplastia, são utilizadas células electrolíticas de quartzo para depositar uma camada fina de um metal desejado num substrato. Este processo melhora as propriedades do substrato, tais como o seu aspeto, durabilidade e resistência à corrosão. A galvanoplastia é normalmente utilizada nas indústrias automóvel, aeroespacial e eletrónica.
Conclusão
Em resumo, as células electrolíticas de quartzo são ferramentas essenciais na produção de metais de elevada pureza e em vários processos electroquímicos. O seu mecanismo de ação envolve a migração de iões, o papel dos eléctrodos na facilitação das reacções de oxidação e redução e a importância do meio eletrolítico. A utilização do quartzo apresenta várias vantagens, nomeadamente o isolamento, a resistência à corrosão e o controlo preciso das reacções. Estas células são amplamente utilizadas na purificação de metais e galvanoplastia, contribuindo para o avanço de várias aplicações industriais.
Aplicações das células electrolíticas de quartzo
As células electrolíticas de quartzo desempenham um papel crucial em várias aplicações industriais, nomeadamente na produção de metais de elevada pureza, na eletrólise da água e na indústria farmacêutica. Estas células são concebidas para suportar temperaturas elevadas e ambientes corrosivos, o que as torna ideais para processos que exigem precisão e fiabilidade.
Produção de metais de alta pureza
Uma das principais aplicações das células electrolíticas de quartzo é a produção de metais de elevada pureza, como o alumínio e o cobre. O processo eletrolítico envolve a utilização de uma corrente contínua para conduzir uma reação química não espontânea. No caso da produção de alumínio, a matéria-prima, a bauxite, é dissolvida num banho de criolite fundido. Os iões de alumínio são então reduzidos no cátodo, resultando na deposição de alumínio puro. Este processo é altamente intensivo em energia, mas garante um nível de pureza de até 99,99%.
Da mesma forma, o cobre de alta pureza é produzido através de um processo conhecido como electrorefinação. Neste processo, o cobre impuro é utilizado como ânodo e, à medida que a corrente é passada através da célula electrolítica, os iões de cobre puro são depositados no cátodo. As impurezas permanecem no eletrólito ou formam uma lama separada no fundo da célula, garantindo a pureza do produto final.
Eletrólise da água
As células electrolíticas de quartzo são também amplamente utilizadas na eletrólise da água, um processo que divide a água nos seus elementos constituintes, o hidrogénio e o oxigénio. Este processo é particularmente útil em indústrias que requerem grandes quantidades destes gases, tais como as indústrias química e farmacêutica. A eletrólise da água envolve a passagem de uma corrente eléctrica através de água contendo iões dissolvidos (normalmente de um sal ou ácido). Os iões de hidrogénio (H+) migram para o cátodo, onde são reduzidos a gás hidrogénio, enquanto os iões de hidróxido (OH-) migram para o ânodo, onde são oxidados a gás oxigénio.

Indústria farmacêutica
Na indústria farmacêutica, as células electrolíticas de quartzo são utilizadas na produção de vários produtos químicos e compostos. Por exemplo, a eletrólise da solução de cloreto de sódio (salmoura) é utilizada para produzir gás cloro e hidróxido de sódio (soda cáustica), ambos matérias-primas essenciais na síntese de muitos produtos farmacêuticos. O controlo preciso do processo eletrolítico proporcionado pelas células de quartzo assegura a elevada pureza e consistência destes produtos químicos, que são essenciais para as aplicações farmacêuticas.
Eletrodeposição e tratamento de superfícies
Outra aplicação significativa das células electrolíticas de quartzo é nos processos de galvanoplastia e tratamento de superfícies. A galvanoplastia envolve a deposição de uma camada fina de um metal específico na superfície de outro metal para melhorar as suas propriedades, como a resistência à corrosão, a resistência ao desgaste ou a estética. As células de quartzo proporcionam um ambiente estável e controlado para estes processos, garantindo revestimentos uniformes e de alta qualidade.
Consumo de energia e eficiência
O consumo de energia nos processos electrolíticos varia consoante o metal que está a ser produzido. Por exemplo, a produção electrolítica de alumínio requer aproximadamente 13-15 kWh de eletricidade por quilograma de metal. Em contrapartida, a refinação de cobre por eletrólise consome entre 150 a 300 kWh por tonelada de cobre refinado. Apesar das elevadas necessidades energéticas, a eficiência e a pureza dos produtos finais tornam estes processos indispensáveis na indústria moderna.
Em conclusão, as células electrolíticas de quartzo são vitais em vários sectores industriais, oferecendo um controlo preciso e uma elevada eficiência na produção de metais de elevada pureza, eletrólise da água e produtos químicos farmacêuticos. A sua capacidade de funcionar em ambientes agressivos e a sua durabilidade fazem delas uma ferramenta essencial nas indústrias modernas de fabrico e transformação.
Vantagens da utilização do quartzo em células electrolíticas
O quartzo, uma forma de sílica (SiO2), é conhecido pelas suas propriedades únicas que o tornam um material ideal para utilização em células electrolíticas. Estas células são cruciais em vários processos industriais, incluindo a produção de químicos, metais e semicondutores. A seleção do quartzo em relação a outros materiais como o vidro deve-se principalmente à sua resistência superior a altas temperaturas, inércia química e excelentes propriedades eléctricas.
Resistência a altas temperaturas
O quartzo pode suportar temperaturas até 1100°C, significativamente mais elevadas do que o vidro, que amolece a cerca de 700°C. Esta resistência a altas temperaturas é vital nas células electrolíticas, onde as temperaturas podem subir consideravelmente devido às correntes eléctricas e às reacções químicas envolvidas. A capacidade do quartzo para manter a sua integridade estrutural em tais condições garante a longevidade e a eficiência do processo eletrolítico.
Inércia química
O quartzo é altamente resistente à maioria dos produtos químicos, incluindo ácidos, álcalis e sais. Esta inércia química é particularmente benéfica em células electrolíticas, onde o ambiente é frequentemente muito corrosivo devido aos electrólitos utilizados. Ao utilizar quartzo, o risco de reacções químicas que poderiam degradar os componentes da célula é minimizado, aumentando assim a durabilidade e o desempenho da célula.

Propriedades eléctricas
Ao contrário do vidro, que é um bom isolante, o quartzo é um excelente condutor de eletricidade. Esta propriedade é crucial nas células electrolíticas, onde a condução eficiente da eletricidade é essencial para que o processo eletrolítico ocorra de forma eficaz. A elevada rigidez dieléctrica do quartzo e a baixa perda eléctrica fazem dele um material ideal para eléctrodos e outros componentes eléctricos dentro da célula.
Pureza e transparência
O quartzo é altamente puro, com um teor de SiO2 de pelo menos 99,9%. Esta elevada pureza é essencial em indústrias como a do fabrico de semicondutores, onde mesmo quantidades mínimas de impurezas podem afetar negativamente o processo. A transparência do quartzo, desde o espetro ultravioleta até ao infravermelho, também permite uma melhor monitorização e controlo do processo eletrolítico, garantindo resultados de maior qualidade.
Propriedades mecânicas e ópticas
O quartzo apresenta propriedades mecânicas excepcionais, incluindo elevada rigidez, elasticidade e resistência ao choque. Estas propriedades garantem que os componentes de quartzo podem suportar as tensões mecânicas encontradas nas células electrolíticas sem comprometer a sua integridade estrutural. Além disso, as excelentes propriedades de transmissão ótica do quartzo permitem a monitorização e o ajuste precisos do processo eletrolítico, contribuindo para uma maior eficiência e precisão.
Aplicações em células electrolíticas
As propriedades únicas do quartzo tornam-no adequado para uma vasta gama de aplicações em células electrolíticas. Os tubos e varetas de quartzo, por exemplo, são utilizados no fabrico de semicondutores para banhos de limpeza após a gravação e maquinagem, e em tubos submetidos a tratamentos térmicos. Nos laboratórios, o quartzo é utilizado em visores, ótica e em vários processos industriais em que a sua resistência ao choque e a sua inércia química são inestimáveis.
Em conclusão, a utilização do quartzo nas células electrolíticas tira partido das suas propriedades superiores, incluindo a resistência a altas temperaturas, a inércia química, as excelentes propriedades eléctricas e as vantagens mecânicas e ópticas. Estas características não só melhoram o desempenho e a longevidade das células electrolíticas, como também contribuem para a produção de resultados de alta qualidade em várias aplicações industriais.
Comparação com outros tipos de células electrolíticas
As células electrolíticas são um tipo fundamental de célula eletroquímica, diferindo significativamente das células galvânicas na sua configuração, função e utilizações típicas. Compreender estas diferenças é crucial para selecionar o tipo de célula adequado para aplicações específicas na investigação e na indústria.
Principais diferenças entre células electrolíticas e galvânicas
-
Conversão de energia:
- Células Galvânicas: Estas células convertem espontaneamente energia química em energia eléctrica. São impulsionadas por reacções redox que ocorrem naturalmente, produzindo um fluxo de electrões do ânodo para o cátodo através de um circuito externo. Exemplos incluem baterias e células de combustível.
- Células electrolíticas: Em contraste, as células electrolíticas requerem uma fonte de energia eléctrica externa para conduzir reacções químicas não espontâneas. São utilizadas em processos como a eletrólise, em que a energia eléctrica é utilizada para decompor compostos ou conduzir reacções numa direção desejada.
-
Espontaneidade das reacções:
- Células Galvânicas: As reacções nas células galvânicas são espontâneas, o que significa que ocorrem sem a necessidade de uma fonte de energia externa, uma vez que a célula esteja montada.
- Células electrolíticas: As reacções nas células electrolíticas não são espontâneas e requerem a entrada de energia eléctrica para prosseguirem.
-
Polaridades dos eléctrodos:
- Células Galvânicas: Nas células galvânicas, o ânodo é o elétrodo negativo onde ocorre a oxidação, e o cátodo é o elétrodo positivo onde ocorre a redução.
- Células electrolíticas: As polaridades são invertidas nas células electrolíticas. O ânodo é positivo e o cátodo é negativo, o que reflecte a necessidade de uma fonte de energia externa para forçar os electrões contra o seu fluxo natural.

Usos típicos de células electrolíticas e galvânicas
- Células Galvânicas: Utilizadas habitualmente em dispositivos do quotidiano, como pilhas (alcalinas, de iões de lítio), células de combustível e células solares. São essenciais para dispositivos electrónicos portáteis, fornecendo uma fonte fiável de energia eléctrica através de reacções químicas espontâneas.
- Células electrolíticas: Utilizadas em processos industriais como a galvanoplastia (revestimento de um metal sobre outro), a eletrólise da água (produção de hidrogénio e oxigénio) e a refinação de metais (por exemplo, refinação de cobre). São também cruciais na produção de produtos químicos como o hidróxido de sódio e o cloro através da eletrólise da salmoura.
Diferenças estruturais
- Células Galvânicas: Normalmente consistem em duas soluções diferentes de electrólitos em recipientes separados, ligados por uma ponte salina para manter a neutralidade eléctrica. Os eléctrodos (ânodo e cátodo) são imersos nestas soluções e um circuito externo permite o fluxo de electrões.
- Células electrolíticas: Têm frequentemente uma estrutura mais simples, com ambos os eléctrodos imersos numa única solução electrolítica. A fonte de energia externa é ligada aos eléctrodos para conduzir o processo eletrolítico.
Conclusão
Embora tanto as células electrolíticas como as galvânicas sejam tipos de células electroquímicas e envolvam reacções redox, têm finalidades fundamentalmente diferentes devido à natureza das suas reacções e às conversões de energia que facilitam. Compreender estas diferenças ajuda a selecionar o tipo de célula adequado para aplicações específicas, quer seja para gerar energia eléctrica espontaneamente ou para conduzir reacções químicas através da entrada de energia eléctrica.
Conclusão
Em conclusão,células electrolíticas de quartzo destacam-se como componentes críticos nos processos industriais modernos, tirando partido das suas propriedades únicas para facilitar reacções químicas precisas e a produção de metais de elevada pureza. A sua capacidade de suportar temperaturas elevadas e a sua inércia química posicionam-nas como alternativas superiores em várias aplicações, desde a eletrólise da água à produção farmacêutica. Apesar de desafios como a manutenção e a degradação dos eléctrodos, a investigação em curso promete inovações que irão aumentar a sua eficiência e expandir a sua utilidade. À medida que as indústrias continuam a evoluir, o papel das células electrolíticas de quartzo irá, sem dúvida, crescer, sublinhando a sua importância no avanço dos processos tecnológicos e químicos.
Produtos relacionados
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
- Célula Eletrolítica Eletroquímica Óptica de Janela Lateral
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
Artigos relacionados
- O Coração de Vidro: Por Que a Boa Ciência Morre em Células Sujas
- A Arquitetura da Invisibilidade: Desconstruindo a Célula "Toda de Quartzo"
- O Diálogo Silencioso: Dominando o Controle em Células Eletrolíticas
- A Arquitetura da Precisão: Por Que os Detalhes Invisíveis Definem o Sucesso Eletroquímico
- O Recipiente da Verdade: Por que o Contêiner Importa Mais do Que a Química