Índice
Introdução às células electroquímicas
As células electroquímicas estão no centro do armazenamento e da conversão de energia. Elas aproveitam as reações químicas para gerar eletricidade ou utilizam a eletricidade para conduzir reações químicas. Estas células são componentes essenciais em vários sistemas electroquímicos, incluindo baterias, células de combustível e galvanoplastia, e são vitais para os avanços nas tecnologias energéticas, veículos eléctricos e engenharia eletroquímica.
Tipos de células electroquímicas
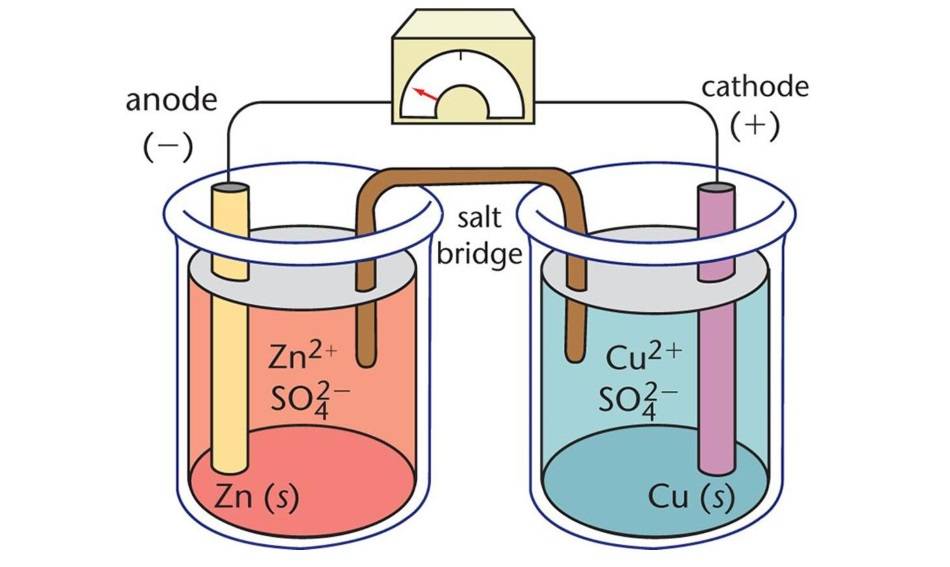
As células electroquímicas são dispositivos que convertem energia química em energia eléctrica (células voltaicas) ou vice-versa (células electrolíticas). São constituídas por dois eléctrodos, um cátodo e um ânodo, imersos numa solução electrolítica.
Células Voltaicas
Também conhecidas como células galvânicas, as células voltaicas geram eletricidade a partir de reacções químicas espontâneas. Numa célula voltaica, o ânodo é o elétrodo negativo onde ocorre a oxidação, libertando electrões. Estes electrões fluem através de um circuito externo para o cátodo, o elétrodo positivo, onde ocorre a redução. A natureza espontânea da reação impulsiona o fluxo de electrões e gera uma corrente eléctrica.
Células electrolíticas
As células electrolíticas, por outro lado, utilizam a eletricidade para conduzir reacções químicas não espontâneas. Numa célula electrolítica, o cátodo é o elétrodo negativo onde ocorre a redução, e o ânodo é o elétrodo positivo onde ocorre a oxidação. Uma fonte de energia externa fornece a energia eléctrica necessária para forçar a reação não espontânea a prosseguir.
Principais diferenças
As principais diferenças entre as células voltaicas e electrolíticas são
- Espontaneidade: As células voltaicas geram eletricidade a partir de reacções espontâneas, enquanto que as células electrolíticas necessitam de energia externa para conduzir reacções não espontâneas.
- Direção do fluxo de electrões: Nas células voltaicas, os electrões fluem do ânodo para o cátodo através do circuito externo. Nas células electrolíticas, os electrões fluem do cátodo para o ânodo através do circuito externo.
- Aplicações: As células voltaicas são utilizadas em baterias, células solares e outros dispositivos que geram eletricidade. As células electrolíticas são utilizadas em galvanoplastia, refinação de metais e outros processos industriais.
Componentes das células electroquímicas
As células electroquímicas são normalmente constituídas pelos seguintes componentes:
- Eléctrodos: O cátodo e o ânodo, feitos de materiais condutores (por exemplo, metais, grafite).
- Eletrólito: Uma solução ou sal fundido que conduz iões, permitindo o fluxo de corrente entre os eléctrodos.
- Separador: Uma barreira porosa que impede que os eléctrodos se toquem diretamente, mas que permite a passagem de iões.
Informações adicionais
- O potencial celular, ou tensão, de uma célula eletroquímica é uma medida da força motriz da reação. Nas células voltaicas, o potencial da célula é positivo, indicando uma reação espontânea. Nas células electrolíticas, o potencial da célula é negativo, indicando uma reação não espontânea.
- A eficiência de uma célula eletroquímica é determinada por factores como os materiais do elétrodo, a concentração do eletrólito e a temperatura.
- As células electroquímicas desempenham um papel crucial em várias aplicações tecnológicas, incluindo o armazenamento de energia, a síntese química e a remediação ambiental.
Componentes das células electrolíticas
As células electrolíticas, um tipo de célula eletroquímica, são dispositivos que utilizam a energia eléctrica para conduzir reacções químicas não espontâneas. São constituídas por três componentes principais: o ânodo, o cátodo e o eletrólito.
Ânodo
O ânodo serve como elétrodo negativo numa célula electrolítica. Durante a reação eletroquímica, o ânodo liberta electrões para o circuito externo e sofre oxidação. Por outras palavras, é no ânodo que ocorre a perda de electrões e a oxidação.
Cátodo
O cátodo, por outro lado, actua como elétrodo positivo. Adquire electrões do circuito externo e é reduzido durante a reação eletroquímica. Assim, é no cátodo que ocorre o ganho de electrões e a redução.
Eletrólito
O eletrólito é uma substância que contém iões móveis quando dissolvida num solvente ou fundida. Nas células electrolíticas, o eletrólito fornece um meio para o fluxo de iões entre o ânodo e o cátodo, completando o circuito elétrico. Os electrólitos comuns incluem soluções aquosas de sais e sais fundidos.
Principais diferenças em relação às células galvânicas
As células electrolíticas diferem das células galvânicas em vários aspectos fundamentais:
- Reacções celulares: As células electrolíticas requerem uma fonte externa de energia eléctrica para conduzir reacções não espontâneas, enquanto que as células galvânicas geram energia eléctrica a partir de reacções espontâneas.
- Fluxo de energia: As células electrolíticas consomem energia eléctrica para promover reacções não espontâneas, enquanto que as células galvânicas convertem energia química em energia eléctrica.
- Cargas dos eléctrodos: Nas células electrolíticas, o ânodo é negativo e o cátodo é positivo, enquanto que nas células galvânicas, o ânodo é positivo e o cátodo é negativo.
Funcionamento de uma célula electrolítica
O funcionamento de uma célula electrolítica envolve os seguintes passos:
- Uma fonte de energia externa (por exemplo, uma bateria) é ligada aos eléctrodos da célula electrolítica.
- A fonte de energia fornece energia eléctrica, que impulsiona a reação não espontânea.
- No ânodo, ocorre a oxidação, libertando electrões para o circuito externo.
- Os electrões fluem através do circuito externo para o cátodo.
- No cátodo, ocorre a redução, consumindo os electrões do circuito externo.
- Os iões do eletrólito migram para manter a neutralidade eléctrica, completando o circuito.
Aplicações das células electrolíticas
As células electrolíticas têm inúmeras aplicações práticas, incluindo:
- Galvanoplastia: Deposição de uma fina camada de metal numa superfície para fins decorativos ou de proteção.
- Eletrólise da água: Produção de hidrogénio e oxigénio a partir da água, que é utilizada em células de combustível e outras aplicações.
- Produção de produtos químicos: Síntese de vários produtos químicos, como cloro, hidróxido de sódio e alumínio.
- Refinação de metais: Purificação de metais através da remoção de impurezas por eletrólise.

Potenciais de elétrodo e reacções redox
As células electroquímicas facilitam as reacções de oxidação-redução (redox). Estas células existem em duas formas: células galvânicas (voltaicas), onde ocorrem reacções espontâneas, e células electrolíticas, onde ocorrem reacções não espontâneas.
Nas células electroquímicas, a reação de oxidação ocorre no ânodo (terminal negativo), enquanto a reação de redução ocorre no cátodo (terminal positivo). Nas células electrolíticas, o ânodo atrai aniões, tornando-o positivo, enquanto nas células galvânicas, o ânodo é negativo devido à libertação de electrões da reação de oxidação espontânea.
A direção do fluxo de electrões e a espontaneidade das reacções redox são determinadas pelo potencial do elétrodo, que é a diferença de potencial entre os eléctrodos. O elétrodo de hidrogénio padrão (SHE) serve como ponto de referência, com uma tensão de 0 volts.
O potencial da célula, que pode ser previsto utilizando os potenciais dos eléctrodos, fornece uma estimativa do potencial medido. Para calcular o potencial da célula, as equações da reação de meia célula devem ser equilibradas e a diferença de tensão entre os potenciais dos eléctrodos deve ser determinada.
O cátodo e o ânodo desempenham papéis distintos nas células electroquímicas:
Cátodo:
- Sinal positivo devido ao consumo de electrões
- Ocorre uma reação de redução
- Os electrões entram
Ânodo:
- Sinal negativo devido à libertação de electrões
- Ocorre a reação de oxidação
- Os electrões saem
Por convenção, o cátodo é representado do lado direito, enquanto o ânodo está do lado esquerdo quando se trata de uma célula eletroquímica.
Aplicações das células electroquímicas
As células electroquímicas têm uma vasta gama de aplicações em vários campos, incluindo armazenamento de energia, conversão e processos industriais.
Galvanoplastia
A galvanoplastia é um processo que utiliza células electroquímicas para aplicar uma fina camada de metal à superfície de outro metal. Este processo melhora as propriedades do metal de base, como a resistência à corrosão, à abrasão e ao desgaste. A galvanoplastia é amplamente utilizada nas indústrias, incluindo a automóvel, a eletrónica e a joalharia, tanto para fins funcionais como estéticos.
Baterias
As células electroquímicas formam a base das pilhas, que são componentes essenciais em numerosos dispositivos e aparelhos electrónicos. As pilhas armazenam energia química e convertem-na em energia eléctrica quando necessário. São vitais para alimentar dispositivos portáteis, como smartphones, computadores portáteis e veículos eléctricos.
Electrolavagem e electrorefinação
As células electroquímicas são utilizadas em processos de electrolavagem e electrorefinação para produzir e purificar metais. A electrolavagem envolve a extração de metais de minérios ou de outras fontes utilizando a eletrólise, enquanto a electrorefinação purifica ainda mais os metais através da remoção de impurezas. Estes processos são cruciais para a obtenção de metais de elevada pureza, como o cobre, o zinco e o alumínio, que são essenciais para várias aplicações industriais.
Outras aplicações
As células electroquímicas também encontram aplicações em várias outras áreas:
- Tratamento de água: São utilizadas na eletrólise da água para produzir gás hidrogénio e gás oxigénio, que são vitais para as células de combustível e outros processos industriais.
- Células de combustível: As células electroquímicas são os componentes principais das células de combustível, que geram eletricidade através de reacções electroquímicas envolvendo hidrogénio e oxigénio.
- Síntese química: As células electroquímicas podem ser utilizadas em processos de síntese química para produzir vários produtos químicos e materiais.
- Sensores e biossensores: As células electroquímicas são utilizadas em sensores e biossensores para detetar e analisar substâncias específicas com base nas suas propriedades electroquímicas.

Conclusão
Células electroquímicascom a sua capacidade de converter energia química em energia eléctrica e vice-versa, são ferramentas indispensáveis em vários domínios. Servem de base para o armazenamento e conversão de energia e para numerosos processos industriais. Desde as baterias que alimentam os nossos dispositivos até às células de combustível que geram energia limpa, as células electroquímicas continuam a moldar os avanços tecnológicos. Compreender os seus princípios e aplicações é fundamental para futuras inovações em tecnologias energéticas, soluções sustentáveis e engenharia eletroquímica.
Produtos relacionados
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica Eletroquímica Óptica de Janela Lateral
- Célula Eletroquímica Eletrolítica de Quartzo para Experimentos Eletroquímicos
Artigos relacionados
- Compreender as Células Electrolíticas de Quartzo: Aplicações, mecanismos e vantagens
- Aplicações da célula electrolítica de tipo H na extração de metais
- Compreender os eléctrodos e as células electroquímicas
- Superar os desafios do funcionamento das células electrolíticas do tipo H
- A Arte da Resistência: Por Que Sua Célula Eletrolítica Precisa de Espaço para Respirar




















