Introdução
Índice
- Introdução
- Definição de célula electrolítica
- Conceito de Eletrólise
- Papel da fonte de corrente contínua nas células electrolíticas
- Definição de eletrólito
- Funções do ânodo e do cátodo em células electrolíticas
- Movimento dos iões nas células electrolíticas
- Aplicação da Eletrólise na Produção de Cobre
- Processo de Purificação do Cobre por Eletrólise
- Resultados finais do processo de purificação do cobre
- Conclusão
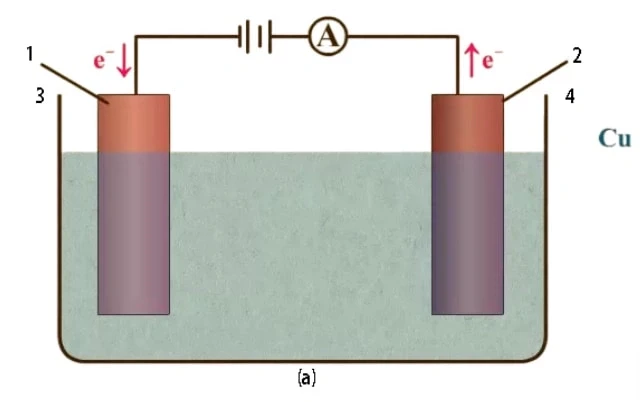
As células electrolíticas desempenham um papel crucial em vários processos industriais, incluindo a purificação do cobre e a galvanoplastia. Estas células utilizam uma fonte de energia externa para conduzir reacções químicas, resultando na decomposição de substâncias. Através do processo de eletrólise, uma corrente eléctrica é passada através de um líquido ou solução contendo iões, provocando a sua decomposição. Nesta publicação do blogue, vamos explorar o conceito de células electrolíticas, o movimento dos iões dentro delas e a sua aplicação na produção de cobre. Então, vamos mergulhar e entender o fascinante mundo das células eletrolíticas!
Definição de célula electrolítica
Uma célula electrolítica é uma célula eletroquímica que utiliza uma fonte de energia externa para conduzir uma reação redox não espontânea. É normalmente utilizada em processos como a eletrólise, em que os compostos químicos são decompostos. A célula electrolítica é constituída por dois eléctrodos, um ânodo (elétrodo com carga positiva) e um cátodo (elétrodo com carga negativa), imersos numa solução electrolítica. A fonte externa de energia eléctrica, como uma pilha, é aplicada entre os eléctrodos para forçar a ocorrência da reação química. Isto é diferente de uma célula galvânica, que é uma fonte de energia eléctrica.
Eletrólise e suas aplicações
A eletrólise é uma técnica que utiliza uma célula electrolítica e uma corrente eléctrica direta para provocar reacções químicas que não ocorreriam espontaneamente. Uma aplicação importante da eletrólise é a decomposição da água em hidrogénio e oxigénio. Este processo é utilizado na produção de gás hidrogénio, que pode ser utilizado como uma fonte de energia limpa e renovável. Outra aplicação significativa é a eletrólise da bauxite para obter alumínio e outros produtos químicos.
A galvanoplastia é outra aplicação comum da eletrólise. Envolve a deposição de uma camada de metal sobre uma superfície utilizando uma célula electrolítica. O cobre, a prata, o níquel e o crómio são alguns dos metais que podem ser galvanizados em vários objectos.
Células electroquímicas e reacções redox
Uma célula eletroquímica é um dispositivo que gera eletricidade a partir de uma reação espontânea de oxidação-redução ou utiliza eletricidade para conduzir uma reação não espontânea. Estas células funcionam com base nos princípios da eletroquímica, que estuda a relação entre a eletricidade e as reacções químicas.
Numa reação redox, os electrões são transferidos de uma espécie para outra. Se a reação for espontânea, liberta energia, que pode ser aproveitada para realizar trabalho útil. Em contrapartida, uma reação não espontânea requer uma entrada de energia para ocorrer. As células electroquímicas facilitam estas reacções, quer gerando energia eléctrica a partir das reacções químicas, quer utilizando energia eléctrica para conduzir as reacções.
Componentes das células electrolíticas
Os componentes primários de uma célula electrolítica são o cátodo, o ânodo e o eletrólito. O cátodo é o elétrodo com carga negativa, enquanto o ânodo é o elétrodo com carga positiva. O eletrólito serve de meio para a troca de electrões entre o cátodo e o ânodo.
Os electrólitos habitualmente utilizados nas células electrolíticas incluem água contendo iões dissolvidos e cloreto de sódio fundido. O fluxo de electrões na célula electrolítica ultrapassa a barreira da energia de ativação da reação redox não espontânea, permitindo a ocorrência da transformação química desejada.
Conclusão
Em suma, uma célula electrolítica é um dispositivo eletroquímico que utiliza energia eléctrica para conduzir uma reação redox não espontânea. É normalmente utilizada em processos como a eletrólise e a galvanoplastia. A compreensão dos princípios da eletroquímica e dos componentes das células electrolíticas é essencial para a utilização destas células em várias aplicações.
Conceito de eletrólise
A eletrólise é o processo de passagem de uma corrente eléctrica através de um líquido ou solução contendo iões, levando à decomposição de substâncias.
Produto da eletrólise
A eletrólise envolve a utilização de eletricidade para quebrar ou decompor um composto, normalmente um composto iónico no estado fundido ou numa solução aquosa. Os produtos da eletrólise podem ser átomos, moléculas, iões ou gases. O tipo de elétrodo e de eletrólito utilizado determina o produto específico do processo de eletrólise.
Na eletrólise, os eléctrodos desempenham um papel crucial na condução da eletricidade de ou para a célula através do movimento dos electrões. Existem dois tipos de eléctrodos:
-
Ânodo: O elétrodo positivo é designado por ânodo. Os iões com carga negativa movem-se em direção ao ânodo e a oxidação tem lugar no ânodo.
-
Cátodo: O elétrodo negativo é designado por cátodo. Os iões com carga positiva deslocam-se em direção ao cátodo, ocorrendo a redução no cátodo.
Eléctrodos na eletrólise
Durante a eletrólise, uma corrente eléctrica é passada para dentro e para fora de uma solução electrolítica para restaurar o fluxo de iões necessários para uma reação não espontânea. O processo envolve a imersão e separação de eléctrodos à distância. A corrente eléctrica, fornecida por uma fonte de energia, viaja através do eletrólito, completando o circuito elétrico.
É utilizada uma corrente contínua (DC) para conduzir a reação de eletrólise. Esta corrente faz com que os iões no eletrólito sejam atraídos para o elétrodo de carga oposta, o cátodo e o ânodo. A quantidade de energia eléctrica necessária é igual à variação da energia livre de Gibbs da reação, juntamente com quaisquer perdas no sistema.
Processo de eletrólise
O processo de eletrólise envolve a utilização de uma célula electrolítica, que consiste em eléctrodos positivos e negativos separados e imersos numa solução que contém iões com carga positiva e negativa. A substância a ser transformada pode formar o elétrodo, constituir a solução ou estar dissolvida na solução.
O elétrodo com carga negativa, conhecido como cátodo, serve de ponto de entrada para a corrente eléctrica. Os componentes da solução migram para o cátodo, combinam-se com os electrões e sofrem redução, resultando na formação de elementos neutros ou de novas moléculas.
Inversamente, os componentes da solução também se deslocam para o elétrodo de carga positiva, chamado ânodo. No ânodo, estes componentes libertam os seus electrões e sofrem oxidação, o que leva à formação de elementos neutros ou de novas moléculas.
Se a substância a ser transformada for o próprio elétrodo, a reação envolve frequentemente a dissolução do elétrodo à medida que este cede electrões.
A eletrólise é um processo fundamental em química que permite a decomposição e transformação de substâncias através da aplicação de corrente eléctrica. Tem desempenhado um papel significativo na descoberta e compreensão de vários elementos da química moderna.
Papel da fonte de corrente contínua nas células electrolíticas
Células electrolíticas
Para compreender o papel de uma fonte de energia de corrente contínua nas células electrolíticas, precisamos primeiro de compreender o conceito de eletrólise. A eletrólise é um processo em que uma corrente eléctrica é passada através de um líquido que contém iões, provocando a decomposição dos compostos no interior do líquido. Este método é normalmente utilizado para separar metais de compostos metálicos, isolar outras substâncias químicas, galvanizar metais e recarregar baterias.
Para que a eletrólise ocorra, é necessário um circuito completo para retirar continuamente eletricidade da célula. Uma célula electrolítica é constituída por dois eléctrodos estáveis, o cátodo e o ânodo, que estão ligados a uma fonte de energia. Estes eléctrodos, juntamente com uma solução electrolítica fluida, são componentes essenciais de cada célula electrolítica. A solução electrolítica conduz eletricidade porque os iões dissolvidos podem mover-se livremente na solução.

Definição: Eletrólise
A eletrólise é um processo em que uma corrente eléctrica é passada através de um líquido ou de uma solução que contém iões, provocando a decomposição das substâncias presentes.
Para sustentar uma reação electrolítica, é necessário um circuito completo para obter continuamente energia de uma bateria ou fonte de alimentação. Para tal, é necessário que os iões se possam mover livremente no eletrólito.
Nas células electrolíticas, é utilizada uma fonte de energia de corrente contínua, o que significa que os eléctrodos são sempre positivos ou negativos. Esta polaridade é crucial para que o processo eletrolítico ocorra eficazmente.
Um eletrólito refere-se a uma substância ou mistura que conduz eletricidade e pode sofrer eletrólise.
Quando uma corrente contínua é passada através do eletrólito numa célula electrolítica, ocorre a eletrólise. No caso da purificação do cobre, o ânodo de cobre impuro é oxidado e forma iões Cu2+. No elétrodo do cátodo, os iões positivos de cobre sofrem uma redução, resultando na produção de cobre metálico puro. As impurezas sob a forma de outros metais não se dissolvem, mas formam uma lama sólida no fundo do recipiente.
Tipos de células electroquímicas
As células electroquímicas podem ser classificadas em três tipos: células recarregáveis, células não recarregáveis e células de combustível.
As pilhas de combustível requerem um fornecimento externo de combustível, que serve como fonte de energia química necessária para gerar eletricidade. Por outro lado, as pilhas recarregáveis e não recarregáveis têm o combustível armazenado internamente na própria pilha.
Compreender o papel de uma fonte de energia de corrente contínua nas células electrolíticas é crucial para aproveitar o poder da eletrólise em vários processos industriais, como a purificação de metais e a galvanoplastia. Ao utilizar uma fonte de energia de corrente contínua, as células electrolíticas permitem a decomposição de substâncias e a criação de substâncias elementares puras ou outros produtos químicos.
Definição de eletrólito
Um eletrólito é um tipo de substância ou mistura que contém iões móveis que podem sofrer eletrólise. Isto significa que quando uma corrente eléctrica é passada através de um eletrólito, a substância que o contém sofre uma alteração química. Os electrólitos podem existir sob a forma de uma solução salina ou de um sal fundido.

Ânodo e cátodo
No contexto da eletrólise, os termos ânodo e cátodo referem-se aos eléctrodos envolvidos no processo. O ânodo é o elétrodo a partir do qual fluem os electrões, enquanto o cátodo é o elétrodo para o qual fluem os electrões. Numa célula electrolítica, o ânodo é o elétrodo positivo.
Condutividade dos electrólitos
Os electrólitos são capazes de conduzir eletricidade porque contêm iões que são livres de se mover. Quando é aplicada uma corrente eléctrica, os aniões do eletrólito movem-se em direção ao ânodo e são oxidados, enquanto os catiões se movem em direção ao cátodo e são reduzidos. Este movimento dos iões permite o fluxo de carga eléctrica através do eletrólito.
Tipos de electrólitos
Existem dois tipos principais de electrólitos: os electrólitos fortes e os electrólitos fracos. Os electrólitos fortes dissociam-se completamente em iões quando dissolvidos numa solução, enquanto os electrólitos fracos se dissociam apenas parcialmente em iões.
Exemplos de electrólitos fortes incluem sais solúveis, ácidos e bases. Estas substâncias permitem que a corrente eléctrica flua entre o ânodo e o cátodo de uma pilha ou célula electrolítica. Por outro lado, os electrólitos fracos não se dissociam totalmente em iões numa solução.

Célula eletroquímica
Uma célula eletroquímica é um dispositivo que converte energia eléctrica em energia química e vice-versa. É constituída por uma solução electrolítica, uma ponte salina e eléctrodos. O eletrólito de uma pilha é a substância que permite o fluxo de corrente eléctrica entre o ânodo e o cátodo. Os electrólitos podem apresentar-se sob a forma de fluidos ou sólidos.
Numa célula eletroquímica, a corrente flui através do eletrólito sob a forma de iões e não de electrões. Os iões com carga negativa, denominados aniões, fluem do cátodo para o ânodo, enquanto os iões com carga positiva, denominados catiões, fluem do ânodo para o cátodo. Este fluxo bidirecional de iões permite a transferência de carga eléctrica através do eletrólito.
Eletrólise
A eletrólise é o processo em que uma corrente eléctrica é passada através de uma substância para induzir uma alteração química. É normalmente realizada numa célula electrolítica, que consiste em eléctrodos positivos e negativos imersos numa solução que contém iões com carga positiva e negativa.
Durante a eletrólise, os electrões entram através do cátodo, fazendo com que os componentes da solução se combinem com os electrões e sofram uma redução. Ao mesmo tempo, os componentes da solução deslocam-se para o ânodo, cedem os seus electrões e sofrem oxidação. Os produtos destas reacções podem ser elementos neutros ou novas moléculas.
Em alguns casos, a substância a ser transformada pode formar o elétrodo, constituir a solução ou estar dissolvida na solução. Independentemente da configuração específica, a eletrólise permite a manipulação controlada de reacções químicas através da aplicação de uma corrente eléctrica.
Funções do ânodo e do cátodo nas células electrolíticas

Ânodo: Elétrodo que fornece electrões ao circuito externo
O ânodo de uma célula electrolítica desempenha um papel crucial no processo eletroquímico. É o elétrodo onde ocorre a oxidação, o que significa que os electrões fluem do ânodo para o circuito externo. Este fluxo de electrões permite a transferência de carga e a conclusão do circuito elétrico dentro da célula.
Nas células electrolíticas, o ânodo tem uma carga positiva. Serve como fonte de electrões necessários para que as reacções de redução ocorram no cátodo. O ânodo é normalmente feito de um material reativo, como o cobre, a prata ou o ouro, que se pode dissociar no eletrólito e facilitar o fluxo de iões.
Cátodo: Elétrodo que aceita os electrões do circuito externo
Por outro lado, o cátodo é o elétrodo que aceita os electrões do circuito externo numa célula electrolítica. É o elétrodo negativo onde ocorrem as reacções de redução. Os electrões que fluem para o cátodo a partir do circuito externo combinam-se com o agente oxidante presente na célula, levando à redução do agente oxidante.
O cátodo é essencial para o funcionamento global da célula electrolítica. Serve como local onde ocorrem as reacções químicas desejadas, resultando nos produtos desejados. No caso da eletrólise, o cátodo é carregado negativamente para atrair catiões carregados positivamente para ele. Quando os catiões atingem o cátodo, podem ser reduzidos ganhando electrões, o que leva à formação dos produtos desejados.
Tanto o ânodo como o cátodo são componentes cruciais das células electrolíticas e encontram-se em vários dispositivos eléctricos, tais como baterias, células de combustível, células fotovoltaicas, células electrolíticas e díodos. O eletrólito, que serve de canal para o fluxo de electrões entre o cátodo e o ânodo, desempenha um papel importante na facilitação das reacções electroquímicas.
Compreender os papéis do ânodo e do cátodo nas células electrolíticas é essencial para compreender os princípios de funcionamento destes dispositivos. O ânodo facilita as reacções de oxidação, enquanto o cátodo permite as reacções de redução, conduzindo às transformações químicas desejadas. Ao aproveitar o poder da eletrólise, várias aplicações, como a produção de cobre puro, podem ser alcançadas de forma eficiente e eficaz.
Movimento dos iões nas células electrolíticas
Catiões: Viajam em direção ao cátodo e são reduzidos
O cátodo é o elétrodo positivo de uma célula electrolítica. É onde ocorre a reação de redução. Os catiões, que são iões de carga positiva, deslocam-se em direção ao cátodo e são reduzidos. Isto significa que ganham electrões no cátodo. Esta reação de redução é essencial em vários processos industriais, como a produção de cobre de elevada pureza e de outros metais como o sódio, o magnésio e o alumínio. Nestes processos, os catiões são electrolisados para produzir o metal desejado.
Aniões: Viajam em direção ao ânodo e são oxidados
O ânodo é o elétrodo negativo de uma célula electrolítica. É onde ocorre a reação de oxidação. Os aniões, que são iões com carga negativa, deslocam-se em direção ao ânodo e são oxidados. Isto significa que perdem electrões no ânodo. A oxidação dos aniões pode levar à libertação de gases como o oxigénio ou à deposição de certos elementos. Por exemplo, na eletrólise dos sais de cobre e prata, os catiões são reduzidos no cátodo, enquanto na eletrólise dos sais de potássio, sódio e cálcio, o gás hidrogénio é libertado devido à redução da água.

Em resumo, nas células electrolíticas, os catiões deslocam-se para o cátodo e são reduzidos, enquanto os aniões se deslocam para o ânodo e são oxidados. Este movimento de iões é crucial para os vários processos electroquímicos que ocorrem nas células electrolíticas.
Cátodo
O cátodo, o elétrodo positivo de uma célula electrolítica, desempenha um papel crucial na reação de redução que ocorre. É o local onde os electrões fluem do circuito elétrico para a parte não metálica da célula. No cátodo, os catiões são reduzidos à medida que absorvem os electrões provenientes do fio ligado ao cátodo. Esta reação de redução é importante em processos como a produção de cobre de elevada pureza e de outros metais.
Eletrólise
A eletrólise é o processo que ocorre numa célula electrolítica, onde a energia eléctrica é utilizada para realizar reacções químicas não espontâneas. Na eletrólise, a oxidação ocorre no ânodo, que é a placa positiva, enquanto a redução ocorre no cátodo, que é a placa negativa. A célula electrolítica converte energia eléctrica em energia química através destas reacções redox.
Condução numa célula electrolítica
Numa célula electrolítica, a corrente passa através do circuito externo à medida que os electrões se movem, mas dentro da própria célula ocorre um processo diferente. Os iões positivos do eletrólito ganham electrões no cátodo e sofrem redução, enquanto os iões negativos migram para o elétrodo positivo (ânodo) onde libertam electrões e sofrem oxidação. Este movimento de iões e electrões no interior da célula é a forma como ocorre o processo de eletrólise.
Tipos de electrólitos
Os electrólitos podem ser classificados como fortes ou fracos, dependendo do grau em que se ionizam numa solução aquosa. Os electrólitos fortes ionizam-se em grande medida e conduzem uma corrente eléctrica forte, enquanto os electrólitos fracos ionizam-se em pequena medida e conduzem uma pequena quantidade de corrente eléctrica.
Ânodo
O ânodo é o elétrodo através do qual a corrente convencional entra numa célula eletroquímica. É o local onde ocorrem as reacções de oxidação. Os iões negativos ou aniões são propensos a reagir e a libertar electrões no ânodo devido ao seu potencial elétrico. Os electrões deslocam-se então através do circuito. Numa célula galvânica, o ânodo é negativo e os electrões deslocam-se em grande parte para a parte exterior do circuito.
Exemplos de eléctrodos
Existem dois tipos de eléctrodos: eléctrodos reactivos e eléctrodos inertes. Os eléctrodos reactivos participam na reação que ocorre na célula e podem dissociar-se no eletrólito. Exemplos de eléctrodos reactivos são o cobre, a prata e o ouro.
Em conclusão, compreender o movimento dos iões nas células electrolíticas é crucial para compreender os processos electroquímicos que ocorrem nestas células. Os catiões deslocam-se para o cátodo e são reduzidos, enquanto os aniões se deslocam para o ânodo e são oxidados. Este movimento de iões e o fluxo de electrões que o acompanha é a base da eletrólise, em que a energia eléctrica é utilizada para conduzir reacções químicas não espontâneas.
Aplicação da Eletrólise na Produção de Cobre
Extração de metais
A eletrólise é amplamente utilizada na extração de metais. Existem dois métodos de extração de metais por eletrólise:

-
Extração de Zinco: Neste processo, o minério de zinco é tratado com ácido sulfúrico para obter uma solução de sulfato de zinco. A solução é então electrolisada num tanque, com cátodos de alumínio e ânodos de chumbo. A densidade de corrente é mantida a 1000 A/m2, e o zinco é depositado no cátodo. O consumo de energia para este processo é de aproximadamente 3000 a 5000 KWH por tonelada.
-
Extração de alumínio: Os minérios de alumínio, como a bauxite e a criolite, são tratados quimicamente e reduzidos a óxido de alumínio. O óxido de alumínio é então dissolvido em criolite fundida e electrolisado num forno. O alumínio deposita-se no cátodo e deposita-se no fundo. A temperatura do forno é mantida a cerca de 1000°C e é necessária uma corrente de cerca de 4000 amperes. A energia consumida neste processo é de aproximadamente 20.000 a 25.000 KWH por tonelada.
Refinação de metais
A eletrólise é também utilizada para a refinação de metais. As principais vantagens da utilização de processos electrolíticos para a refinação de metais são a elevada pureza do produto obtido (cerca de 98 a 99%) e a possibilidade de refinar ainda mais o metal. No processo de refinação, o ânodo é constituído pelo metal extraído e o metal puro é depositado no cátodo. O eletrólito utilizado é constituído pela solução metálica, como o sulfato de cobre para a refinação de cobre e o cloreto de níquel para a refinação de níquel. O consumo de energia para a refinação de cobre por processo eletrolítico é de aproximadamente 150 a 300 KWH por tonelada de cobre refinado.
Em geral, a eletrólise desempenha um papel crucial na extração e refinação de metais, garantindo uma elevada pureza e qualidade do produto final.
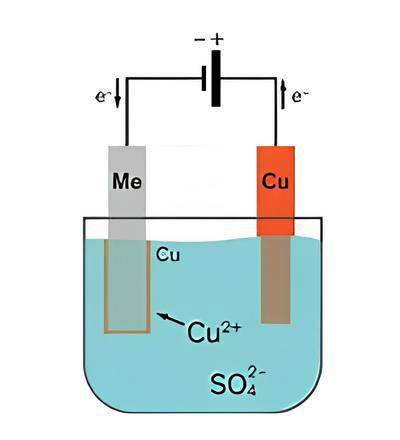
Processo de Purificação de Cobre por Eletrólise
Placas de cobre impuro são colocadas num banho de solução de sulfato de cobre (II)
No processo de purificação do cobre por eletrólise, as placas de cobre impuro são inicialmente produzidas a partir da extração de minério de cobre. No entanto, estas placas de cobre impuro não são suficientemente puras para serem utilizadas na eletrónica e noutras aplicações críticas. Para obter placas de cobre mais puras, recorre-se à eletrólise.
As placas de cobre impuro são colocadas num banho de solução de sulfato de cobre(II). Esta solução actua como eletrólito no processo de eletrólise. As placas de cobre impuro são ligadas ao terminal positivo de uma fonte de alimentação externa, enquanto uma placa de cobre puro é ligada ao terminal negativo da fonte de alimentação.
A fonte de alimentação externa provoca reacções que conduzem ao revestimento do cátodo com cobre
A fonte de alimentação externa provoca duas reacções no processo de eletrólise. No ânodo (a placa de cobre impuro), o cobre é oxidado e dissolvido no eletrólito sob a forma de iões Cu2+:
Cu(s) ⇒ Cu2+(aq) + 2e-
Esta reação de oxidação faz com que o ânodo de cobre impuro perca massa à medida que o cobre se dissolve no eletrólito.
No cátodo (a placa de cobre puro), os iões de cobre no eletrólito são reduzidos ganhando electrões para formar cobre metálico:
Cu2+ (aq) + 2e- ⇒ Cu(s)
Esta reação de redução faz com que o cobre metálico seja revestido no cátodo, resultando no ganho de massa do cátodo.
As impurezas presentes nas placas de cobre impuro são deixadas para trás no eletrólito. As impurezas solúveis permanecem no eletrólito, enquanto as impurezas insolúveis permanecem no ânodo ou caem no fundo do recipiente de reação.
O processo de eletrólise é amplamente utilizado na produção de cobre puro. O cobre é um metal altamente condutor utilizado em várias aplicações, como circuitos, fios, tubagens e unidades de refrigeração. É também conhecido pela sua maleabilidade e ductilidade.
A eletrólise desempenha um papel crucial na fase final de purificação da produção de cobre. Utilizando uma célula electrolítica com uma solução de sulfato de cobre (II) como eletrólito, as placas de cobre impuras podem ser transformadas em placas de cobre de elevada pureza. Este processo assegura que as placas de cobre cumprem as normas de pureza exigidas para as aplicações a que se destinam.
Em geral, a eletrólise é um método importante na metalurgia, permitindo a conversão de cobre impuro em cobre de elevada pureza. Também é utilizada para a extração e refinação de outros metais, como o sódio, o magnésio e o alumínio. A eletrólise é um processo versátil que permite a produção de metais puros em grande escala.
Resultados Finais do Processo de Purificação do Cobre
O ânodo de cobre impuro perde massa

Durante o processo de purificação do cobre, o ânodo de cobre impuro sofre oxidação e perde massa. Os átomos de cobre do ânodo dissolvem-se na solução electrolítica como iões Cu2+.
O cátodo de cobre puro ganha massa
Ao mesmo tempo, o cobre puro é revestido no cátodo. Os iões de cobre da solução electrolítica são reduzidos no cátodo, resultando na deposição de cobre metálico puro. Como resultado, o cátodo de cobre puro ganha massa ao longo do processo de purificação.
As impurezas solúveis permanecem no eletrólito
Durante o processo de purificação, as impurezas solúveis presentes no ânodo de cobre impuro não se depositam no cátodo. Em vez disso, permanecem na solução electrolítica. Isto permite a separação das impurezas do cobre purificado.
As impurezas insolúveis permanecem no ânodo ou caem para o fundo do vaso de reação
As impurezas insolúveis, tais como outros metais ou partículas sólidas, permanecem incorporadas no ânodo de cobre impuro ou caem para o fundo do vaso de reação. Estas impurezas não se dissolvem na solução electrolítica e são fisicamente separadas do cobre purificado.
O processo de purificação envolve a utilização de eletrólise, em que a energia eléctrica é utilizada para conduzir as reacções químicas. O ânodo de cobre impuro actua como fonte de iões de cobre, enquanto o cátodo de cobre puro serve como local para a deposição de cobre. Ao controlar cuidadosamente o processo, as impurezas são deixadas para trás, resultando num cobre de elevada pureza.
É importante notar que o eletrólito utilizado no processo de purificação, como o sulfato de cobre, desempenha um papel crucial para facilitar o movimento dos iões e permitir a separação das impurezas. Além disso, a temperatura e a corrente utilizadas durante a eletrólise afectam a eficiência do processo de purificação.
Em geral, os resultados finais do processo de purificação do cobre incluem a perda de massa do ânodo de cobre impuro, o ganho de massa pelo cátodo de cobre puro, a retenção de impurezas solúveis no eletrólito e a separação de impurezas insolúveis no ânodo ou no fundo do vaso de reação. Estes resultados conduzem à produção de cobre de elevada pureza, tornando a purificação electrolítica um método essencial na indústria metalúrgica.
Conclusão
Em conclusão,células electrolíticas desempenham um papel crucial na purificação e galvanoplastia do cobre. Ao utilizar uma fonte de energia externa para conduzir as reacções, a eletrólise permite a decomposição de substâncias num líquido ou solução contendo iões. O ânodo fornece electrões ao circuito externo, enquanto o cátodo aceita electrões. Os catiões dirigem-se para o cátodo e são reduzidos, enquanto os aniões se dirigem para o ânodo e são oxidados. No processo de purificação do cobre, as placas de cobre impuro são imersas numa solução de sulfato de cobre e o cátodo é revestido com cobre puro. O resultado é uma redução das impurezas no ânodo e a produção de cobre de alta qualidade.
Produtos relacionados
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
- Célula Eletrolítica Eletroquímica Óptica de Janela Lateral
- Célula Eletroquímica Eletrolítica em Banho de Água Óptico
- Célula Eletrolítica Eletroquímica de Corrosão Plana
Artigos relacionados
- Superar os desafios do funcionamento das células electrolíticas do tipo H
- A Variável Invisível: Dominando a Inspeção da Célula Eletrolítica
- Eletroquímica A ciência por detrás das células electroquímicas
- Compreender as Células Electrolíticas de Quartzo: Aplicações, mecanismos e vantagens
- Aplicações das células electrolíticas na purificação e galvanoplastia