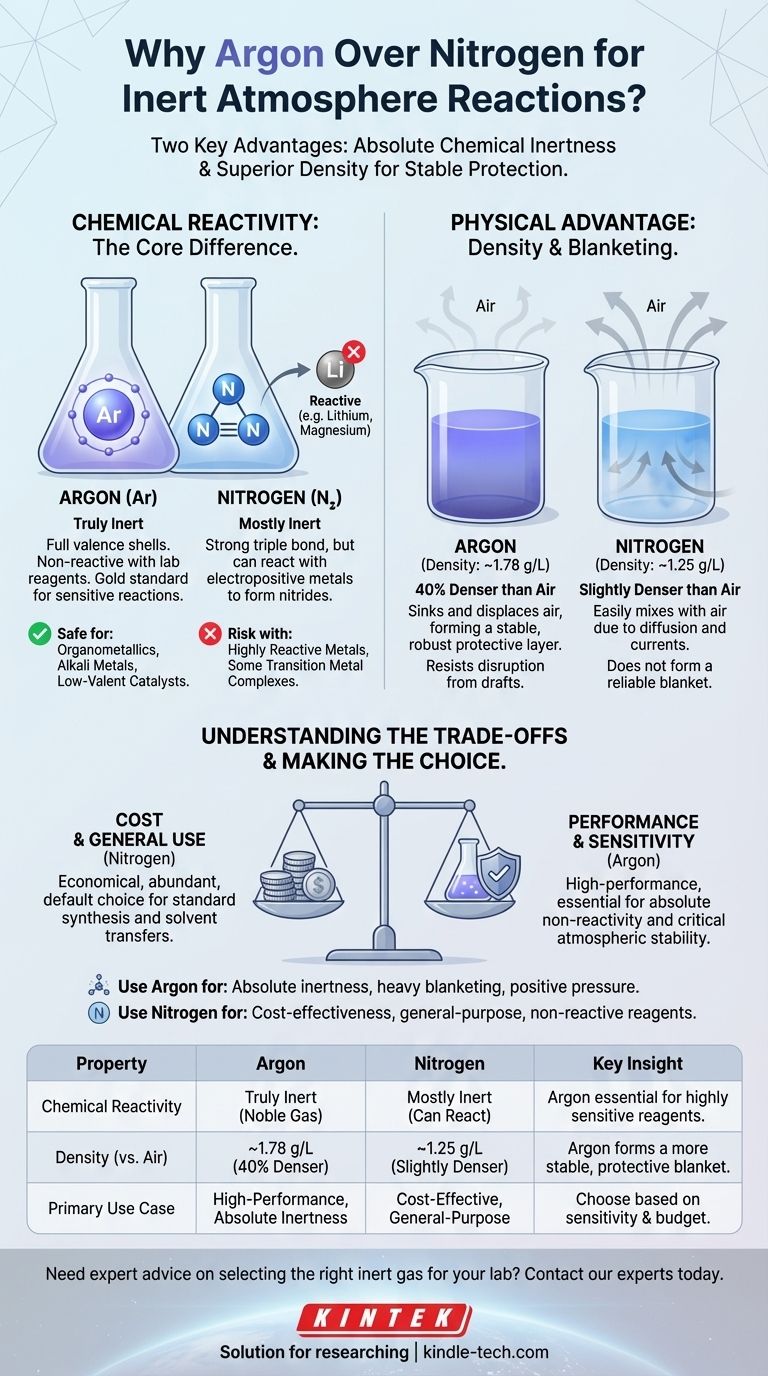
Na prática, o argônio é frequentemente considerado "melhor" que o nitrogênio para reações em atmosfera inerte devido a duas propriedades-chave. O argônio é um gás nobre verdadeiramente inerte, incapaz de reagir com reagentes de laboratório, enquanto o nitrogênio pode reagir sob certas condições. Além disso, a maior densidade do argônio permite que ele forme um "manto" mais estável e protetor sobre uma reação, deslocando o ar de forma mais eficaz.
A escolha entre argônio e nitrogênio não é sobre qual é universalmente melhor, mas qual é mais apropriado para uma tarefa específica. O nitrogênio é o cavalo de batalha econômico para inertização de uso geral, enquanto o argônio é a opção de alto desempenho para reações que exigem não reatividade absoluta e estabilidade atmosférica.

A Diferença Essencial: Reatividade Química
A razão mais fundamental para escolher um gás em detrimento do outro se resume ao seu potencial de participar de sua reação.
Argônio: A Definição de Inerte
O argônio é um gás nobre. Suas camadas de elétrons de valência estão completamente preenchidas, tornando-o excepcionalmente estável e não reativo em praticamente todas as condições de laboratório.
Para um químico, este é o padrão ouro. Você pode ter certeza de que o argônio não interferirá em sua reação, por mais sensíveis que sejam os reagentes.
Nitrogênio: "Principalmente" Inerte
O gás nitrogênio (N₂) é composto por dois átomos de nitrogênio unidos por uma ligação tripla muito forte. Esta ligação requer muita energia para ser quebrada, razão pela qual o N₂ é principalmente inerte e serve bem para muitas aplicações.
No entanto, não é completamente não reativo. Reagentes altamente reativos, particularmente metais eletropositivos como lítio, magnésio e alguns complexos de metais de transição, podem reagir com N₂ para formar nitretos metálicos. Esta reação secundária indesejada pode reduzir seu rendimento ou introduzir impurezas.
A Vantagem Física: Densidade
Além da reatividade química, o comportamento físico do gás no laboratório é um fator crítico. O ar é uma mistura de gases, mas tem uma densidade média que podemos comparar.
- Densidade do Argônio: ~1,78 g/L
- Densidade do Ar: ~1,23 g/L
- Densidade do Nitrogênio: ~1,25 g/L
Como a Densidade Cria um "Manto" Protetor
O argônio é aproximadamente 40% mais denso que o ar. Quando você purga um balão com argônio, ele efetivamente afunda e desloca o ar mais leve, empurrando-o para cima e para fora. Ele então se deposita sobre sua mistura reacional, formando um manto estável e pesado que resiste à perturbação.
O nitrogênio, em contraste, é apenas ligeiramente mais denso que o ar. É muito mais suscetível a se misturar com o ar devido à difusão e a pequenas correntes de ar ou correntes de convecção na sala. Ele não forma a mesma camada protetora robusta.
Implicações Práticas para Montagens de Laboratório
Essa diferença de densidade tem consequências no mundo real. Em uma caixa de luvas ou em uma linha Schlenk, uma pressão positiva de argônio fornece uma atmosfera mais tolerante. Se ocorrer um pequeno vazamento, o argônio denso fluirá preferencialmente para fora, impedindo que o ar mais leve flua para dentro.
Para técnicas que dependem de cobrir um recipiente aberto, como em muitos experimentos eletroquímicos, o argônio é vastamente superior porque permanecerá assentado sobre a solução. O nitrogênio simplesmente se misturaria com o ar circundante quase imediatamente.
Entendendo as Compensações
A escolha do gás ideal requer o equilíbrio entre desempenho e restrições práticas.
Custo: O Fator Decisivo para Muitos
O nitrogênio compõe cerca de 78% da atmosfera terrestre, enquanto o argônio compõe menos de 1%. Essa diferença de abundância torna o nitrogênio significativamente mais barato para produzir e comprar.
Para processos industriais em larga escala ou procedimentos de laboratório de rotina onde a inércia extrema não é necessária, a economia de custos do uso de nitrogênio é substancial e muitas vezes o torna a escolha padrão.
Reatividade: Quando "Principalmente" Inerte é Suficiente
A reatividade potencial do nitrogênio só importa se seu sistema químico for capaz de quebrar essa ligação tripla N≡N.
Para a grande maioria das reações orgânicas, purificações e transferências de solventes, o nitrogênio é perfeitamente adequado. Os reagentes simplesmente não são reativos o suficiente para formar nitretos, tornando o argônio uma despesa desnecessária.
Fazendo a Escolha Certa para Sua Reação
Baseie sua decisão nas demandas específicas de seu procedimento químico e nas realidades práticas de seu laboratório.
- Se seu foco principal é a inércia absoluta para reagentes sensíveis: Use argônio ao trabalhar com organometálicos (especialmente aqueles envolvendo Li, Mg), metais alcalinos, catalisadores de metais de transição de baixa valência ou qualquer sistema onde a formação de nitretos seja um risco conhecido.
- Se seu foco principal é a relação custo-benefício e o uso geral: Use nitrogênio para a maioria das sínteses orgânicas padrão, destiladores de solventes, recristalizações e outros procedimentos que não envolvem espécies excepcionalmente reativas.
- Se seu foco principal é manter uma atmosfera estável: Use argônio para técnicas que exigem um manto pesado de gás, como eletroquímica, ou em montagens onde manter uma pressão positiva contra vazamentos potenciais é crítico.
Em última análise, compreender as propriedades químicas e físicas distintas de cada gás o capacita a fazer a escolha mais informada e econômica para seu experimento.
Tabela Resumo:
| Propriedade | Argônio | Nitrogênio | Principal Conhecimento |
|---|---|---|---|
| Reatividade Química | Verdadeiramente inerte (gás nobre) | Principalmente inerte, mas pode reagir com metais eletropositivos | O argônio é essencial para reagentes altamente sensíveis. |
| Densidade (vs. Ar) | ~1,78 g/L (40% mais denso) | ~1,25 g/L (ligeiramente mais denso) | O argônio forma um manto protetor mais estável. |
| Caso de Uso Primário | Reações de alto desempenho que exigem inércia absoluta | Solução econômica para inertização de uso geral | Escolha com base na sensibilidade da sua reação e orçamento. |
Precisa de aconselhamento especializado sobre como selecionar o gás inerte certo para sua aplicação específica de laboratório?
A KINTEK é especializada no fornecimento de gases e equipamentos de laboratório de alta pureza, incluindo sistemas de argônio e nitrogênio, para garantir que suas reações sensíveis estejam perfeitamente protegidas. Nossa equipe pode ajudá-lo a otimizar sua configuração para rendimento e segurança máximos.
Entre em contato com nossos especialistas hoje para discutir suas necessidades de atmosfera inerte e encontrar a solução mais eficiente para seu laboratório.
Guia Visual
Produtos relacionados
- Forno com Atmosfera Controlada de 1400℃ com Nitrogênio e Atmosfera Inerte
- Forno com Atmosfera Controlada de 1200℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Atmosfera Controlada de 1700℃ Forno de Atmosfera Inerte de Nitrogênio
- Forno de Hidrogênio com Atmosfera Inerte Controlada
- Forno de Tubo de Laboratório de Alta Temperatura de 1400℃ com Tubo de Alumina
As pessoas também perguntam
- Quais gases são usados em atmosferas inertes? Escolha o Gás Certo para Ambientes Não Reativos
- O gás nitrogênio pode ser aquecido? Aproveite o Calor Inerte para Precisão e Segurança
- Como um forno de alta temperatura com controle de atmosfera otimiza revestimentos de espinélio? Alcance precisão de sinterização redox
- Quais são as funções do nitrogênio (N2) em atmosferas controladas de fornos? Obtenha resultados superiores de tratamento térmico
- O que é atmosfera de nitrogênio para recozimento? Alcance tratamento térmico livre de oxidação



















