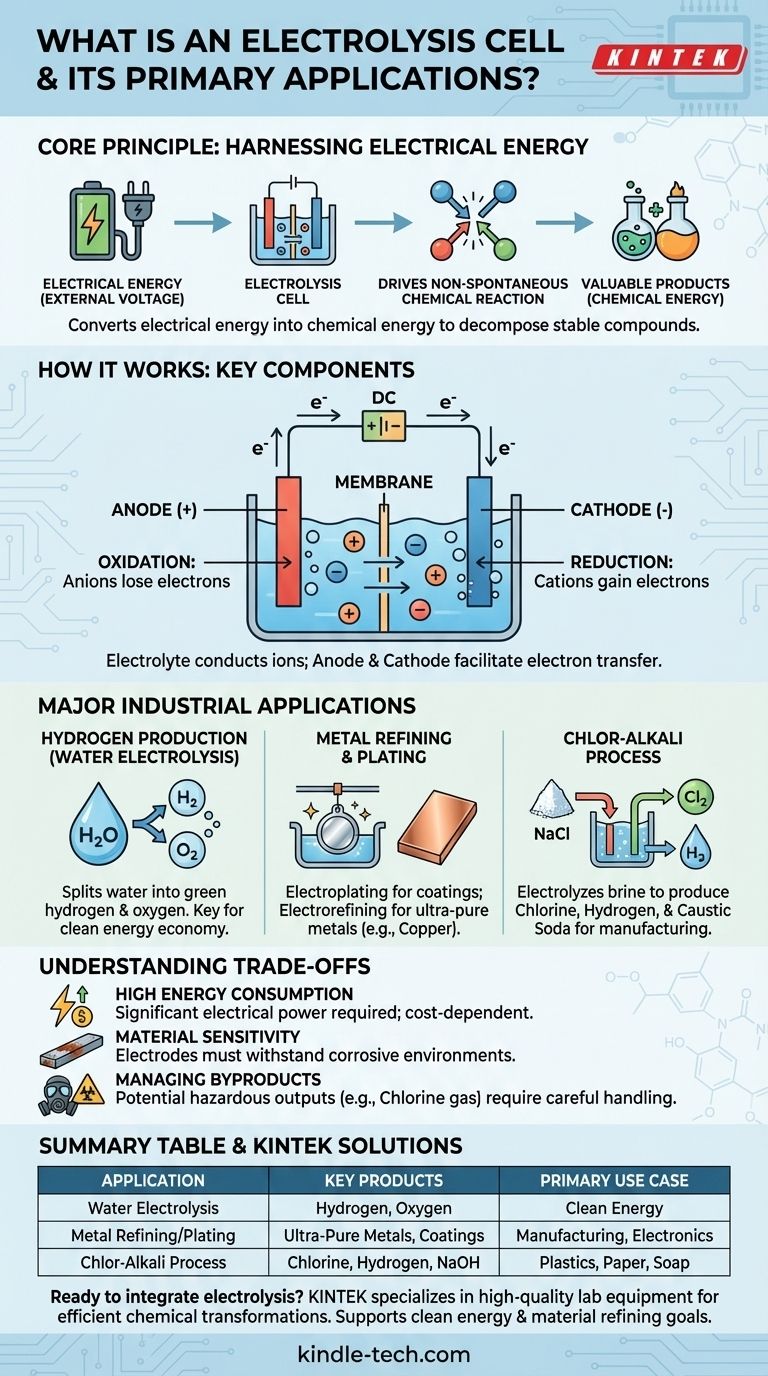
Em essência, uma célula eletrolítica é um dispositivo que aproveita a energia elétrica para impulsionar uma reação química que, de outra forma, não ocorreria por si só. Ela funciona passando uma corrente elétrica através de uma substância, tipicamente uma solução contendo íons, para decompô-la ou transformá-la. As principais aplicações industriais incluem a produção de hidrogênio a partir da água, o refino de metais como o cobre e a fabricação de produtos químicos essenciais como o cloro e o hidróxido de sódio.
Uma célula eletrolítica converte fundamentalmente energia elétrica em energia química. Ela supera a estabilidade natural dos compostos, usando a eletricidade como uma ferramenta para quebrá-los e criar novas substâncias, muitas vezes mais valiosas.

Como Funciona uma Célula Eletrolítica
Uma célula eletrolítica opera com base no princípio da eletrólise, que literalmente significa "separar com eletricidade". Este processo é o oposto do que acontece em uma bateria (uma célula galvânica), que produz eletricidade a partir de uma reação química espontânea.
O Princípio Central: Forçando uma Reação
Muitos compostos químicos valiosos, como água (H₂O) ou sal (NaCl), são muito estáveis. Eles não se decompõem espontaneamente em seus elementos constituintes.
Uma célula eletrolítica fornece a energia necessária, na forma de uma voltagem externa, para forçar essas reações não espontâneas a acontecerem. Essa entrada de energia supera as ligações químicas que mantêm o composto unido.
Componentes Chave
Toda célula eletrolítica possui três componentes primários:
- Ânodo: O eletrodo positivo. No ânodo, íons carregados negativamente (ânions) perdem elétrons em um processo chamado oxidação.
- Cátodo: O eletrodo negativo. No cátodo, íons carregados positivamente (cátions) ganham elétrons em um processo chamado redução.
- Eletrólito: Uma substância (geralmente uma solução) contendo íons em movimento livre. O eletrólito conduz eletricidade e fornece a matéria-prima para a reação.
O tipo de eletrodos e o eletrólito específico usados são cuidadosamente escolhidos porque determinam diretamente quais produtos serão formados.
Principais Aplicações Industriais
A capacidade de controlar precisamente as transformações químicas com eletricidade torna a eletrólise um pilar da indústria moderna.
Produção de Hidrogênio a partir da Água
Talvez a aplicação mais discutida hoje seja a eletrólise da água. Ao passar uma corrente através da água (contendo um eletrólito adequado), a célula divide as moléculas de H₂O em seus componentes.
O gás oxigênio se forma no ânodo, enquanto o gás hidrogênio puro se forma no cátodo. Quando a eletricidade utilizada provém de fontes renováveis, o produto resultante é chamado de "hidrogênio verde", um componente chave em uma futura economia de energia limpa.
Refino e Galvanoplastia de Metais
A eletrólise é crítica para a produção e purificação de metais. Na galvanoplastia, um objeto é colocado como cátodo em uma célula contendo íons do metal de revestimento desejado (como cromo ou níquel). Os íons metálicos são reduzidos sobre o objeto, formando um revestimento fino e durável.
Da mesma forma, o eletrorefino é usado para produzir metais ultra-puros. Uma placa impura de cobre, por exemplo, é usada como ânodo. Quando a corrente é aplicada, os átomos de cobre se dissolvem no eletrólito, viajam para o cátodo e se redepositam como cobre quase 100% puro, deixando as impurezas para trás.
O Processo Cloro-Álcali
Este enorme processo industrial é um dos usos mais significativos da eletrólise. Uma solução forte de cloreto de sódio (salmoura) é eletrolisada.
O resultado é a produção de três produtos químicos básicos altamente valiosos a partir de água salgada simples: gás cloro, gás hidrogênio e hidróxido de sódio (soda cáustica). Estes são ingredientes fundamentais para a fabricação de plásticos, papel, sabões e milhares de outros produtos.
Compreendendo as Desvantagens
Embora poderosa, a eletrólise não é uma solução universal. Sua aplicação envolve considerações significativas.
Alto Consumo de Energia
A principal desvantagem da eletrólise é sua alta exigência de energia. Forçar um composto estável a se decompor requer uma quantidade substancial de energia elétrica, o que pode tornar o processo caro. A viabilidade econômica de um processo eletrolítico está frequentemente diretamente ligada ao custo da eletricidade.
Sensibilidade e Corrosão de Materiais
Os próprios eletrodos fazem parte de um ambiente químico ativo. Eles devem ser capazes de suportar condições corrosivas e altas temperaturas sem degradar ou reagir de maneiras indesejadas. A escolha do material correto para o eletrodo é crucial para a eficiência e longevidade.
Gerenciamento de Subprodutos
A eletrólise pode produzir subprodutos perigosos ou difíceis de manusear. Por exemplo, no processo cloro-álcali, o gás cloro produzido é tóxico e deve ser gerenciado com extremo cuidado. O impacto ambiental geral depende fortemente tanto da fonte de eletricidade quanto do manuseio seguro de todos os produtos.
Fazendo a Escolha Certa para o Seu Objetivo
O design e a operação de uma célula eletrolítica são adaptados especificamente ao seu propósito pretendido.
- Se o seu foco principal é produzir metais de alta pureza: Seu processo se concentrará no eletrorefino ou eletro-extração, onde o controle preciso da voltagem e a pureza do eletrólito são primordiais para garantir a qualidade do produto.
- Se o seu foco principal é gerar produtos químicos básicos: Você provavelmente usará um modelo como o processo cloro-álcali, que é otimizado para produção contínua e em larga escala a partir de uma matéria-prima barata como a salmoura.
- Se o seu foco principal é criar transportadores de energia limpa: Seus esforços envolverão a eletrólise da água, onde a eficiência da célula e a integração com fontes de energia renovável de baixo custo são os fatores mais críticos para o sucesso.
Ao aplicar energia elétrica direcionada, uma célula eletrolítica transforma insumos básicos em produtos de alto valor, tornando-a uma ferramenta fundamental da química e da indústria modernas.
Tabela Resumo:
| Aplicação | Principais Produtos | Principal Caso de Uso |
|---|---|---|
| Eletrólise da Água | Gás Hidrogênio & Oxigênio | Energia Limpa (Hidrogênio Verde) |
| Refino/Galvanoplastia de Metais | Metais Ultra-Puros, Revestimentos Protetores | Manufatura, Eletrônicos |
| Processo Cloro-Álcali | Cloro, Hidrogênio, Hidróxido de Sódio | Produção de Plásticos, Papel, Sabão |
Pronto para integrar a tecnologia de eletrólise em seu laboratório ou processo industrial? A KINTEK é especializada em equipamentos e consumíveis de laboratório de alta qualidade, fornecendo as ferramentas confiáveis de que você precisa para transformações químicas eficientes e precisas. Seja você desenvolvendo soluções de energia limpa ou refinando materiais, nossa expertise apoia seus objetivos. Entre em contato com nossa equipe hoje para discutir como podemos aprimorar suas operações.
Guia Visual
Produtos relacionados
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
As pessoas também perguntam
- Que precaução geral deve ser tomada ao manusear a célula eletrolítica? Garanta Resultados de Laboratório Seguros e Precisos
- Qual é a maneira adequada de manusear uma célula eletrolítica de banho-maria de cinco portas? Garanta Experimentos Eletroquímicos Precisos e Seguros
- Quais são os componentes padrão da célula eletrolítica de banho-maria de cinco portas? Domine o Instrumento de Precisão para Análise Eletroquímica
- Quais são os procedimentos corretos de armazenamento para a célula eletrolítica multifuncional? Proteja seu Investimento e Garanta a Precisão dos Dados
- Como as fugas podem ser evitadas ao usar uma célula eletrolítica de banho-maria de cinco portas? Garanta uma Configuração Eletroquímica Confiável e Segura



















