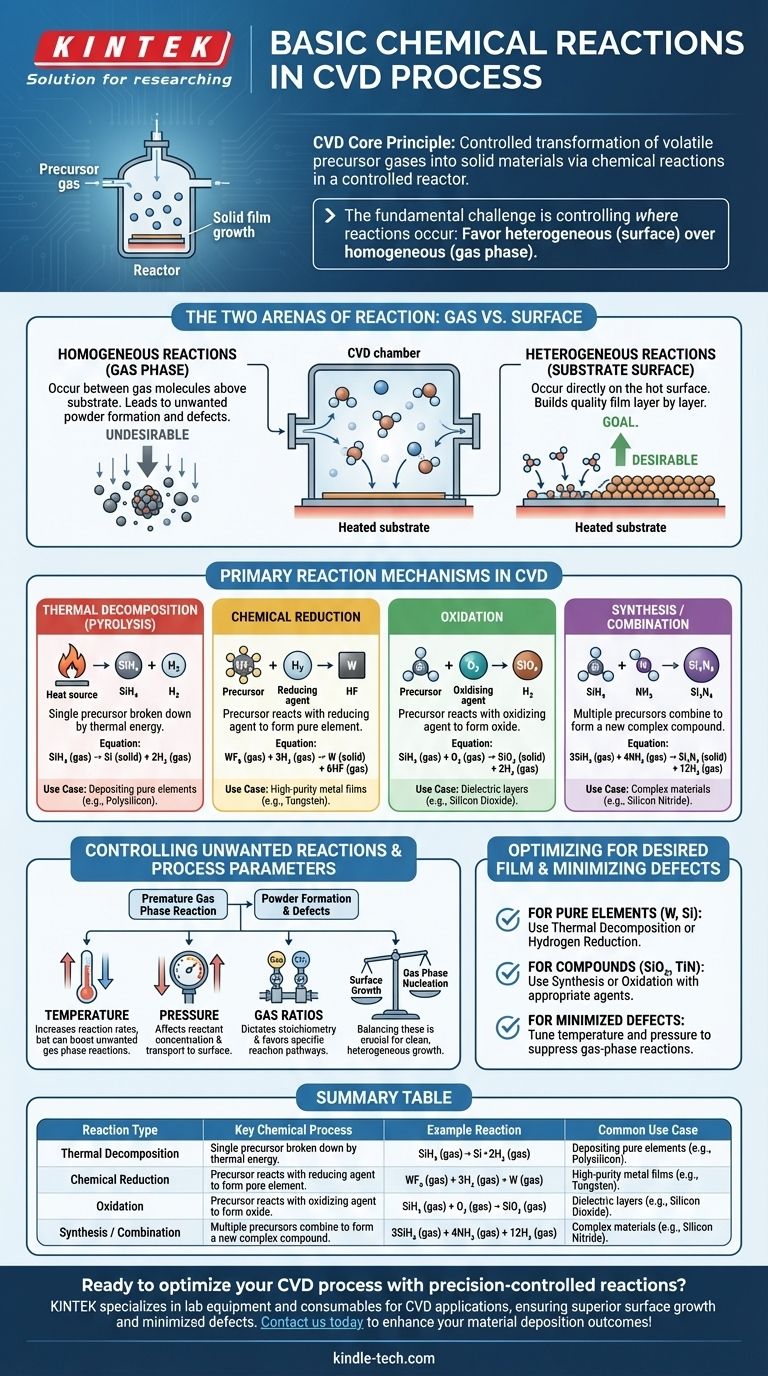
Em sua essência, a Deposição Química a Vapor (CVD) é um processo de reações químicas controladas. Essas reações são projetadas para transformar gases precursores estáveis e voláteis em um material sólido e não volátil diretamente sobre um substrato. Os mecanismos mais comuns que impulsionam essa transformação são a decomposição térmica (pirólise), a redução química, a oxidação e as reações de síntese, todas ocorrendo dentro de um ambiente de reator altamente controlado.
O desafio fundamental em qualquer processo CVD não é apenas iniciar reações químicas, mas controlar precisamente onde elas ocorrem. O objetivo é favorecer reações heterogêneas na superfície do substrato para construir um filme de qualidade, minimizando as reações homogêneas na fase gasosa que criam partículas indesejadas.

As Duas Arenas de Reação: Gás vs. Superfície
Toda reação química em uma câmara CVD acontece em um de dois lugares. O equilíbrio entre eles determina a qualidade e a estrutura do material final.
Reações Homogêneas (Na Fase Gasosa)
Essas reações ocorrem entre as próprias moléculas de gás, suspensas no espaço acima do substrato.
Embora alguma química na fase gasosa seja necessária para criar espécies intermediárias reativas, reações homogêneas excessivas são frequentemente indesejáveis. Elas podem levar à formação de partículas sólidas ou "pós" que então caem sobre o substrato, causando defeitos e comprometendo a qualidade do filme.
Reações Heterogêneas (Na Superfície do Substrato)
Essas são as reações que constroem o filme. Elas acontecem diretamente sobre, ou em uma camada muito fina adjacente à, superfície aquecida do substrato.
O objetivo de um processo CVD bem projetado é maximizar a taxa de reações heterogêneas. Os gases precursores adsorvem na superfície quente, decompõem-se ou reagem com outras espécies adsorvidas, e formam o filme sólido estável camada atômica por camada atômica.
Mecanismos de Reação Primários em CVD
Embora ocorrendo em uma das duas "arenas" acima, as próprias reações podem ser categorizadas em vários tipos principais com base na transformação química envolvida.
Decomposição Térmica (Pirólise)
Este é o tipo de reação CVD mais simples e comum. Um único gás precursor é decomposto em suas partes constituintes apenas por energia térmica.
O calor do substrato fornece a energia necessária para quebrar as ligações químicas da molécula precursora, deixando o elemento sólido desejado para depositar na superfície. Um exemplo clássico é a deposição de polissilício a partir de gás silano.
SiH₄ (gás) → Si (sólido) + 2H₂ (gás)
Redução Química
Neste processo, um gás precursor (geralmente um halogeneto metálico) reage com um agente redutor, tipicamente hidrogênio (H₂), para formar um filme elementar puro.
Este é um método comum para depositar filmes metálicos de alta pureza, como o tungstênio. O hidrogênio remove os átomos de halogênio do precursor metálico, permitindo que o metal puro se deposite.
WF₆ (gás) + 3H₂ (gás) → W (sólido) + 6HF (gás)
Oxidação
Esta reação envolve um gás precursor reagindo com um agente oxidante, como oxigênio (O₂), óxido nitroso (N₂O) ou vapor (H₂O), para formar um filme de óxido sólido.
Este é o processo fundamental para a criação de camadas dielétricas isolantes como o dióxido de silício (SiO₂), um componente crítico em quase todos os microeletrônicos modernos.
SiH₄ (gás) + O₂ (gás) → SiO₂ (sólido) + 2H₂ (gás)
Síntese ou Combinação
Aqui, dois ou mais gases precursores são introduzidos para combinar e formar um novo material composto no substrato. Isso permite a criação de materiais complexos que não podem ser formados por simples decomposição.
Por exemplo, o nitreto de silício (Si₃N₄), um material duro e quimicamente resistente, é formado pela reação de uma fonte de silício com uma fonte de nitrogênio, como a amônia.
3SiH₄ (gás) + 4NH₃ (gás) → Si₃N₄ (sólido) + 12H₂ (gás)
Compreendendo os Compromissos: Controlando Reações Indesejadas
O sucesso de um processo CVD depende inteiramente do controle do ambiente de reação para favorecer as vias químicas desejadas.
O Problema da Formação de Pó
A principal armadilha no CVD é a nucleação não intencional na fase gasosa. Se a temperatura do reator for muito alta ou a pressão for muito grande, os gases precursores podem reagir prematuramente na fase gasosa (reação homogênea) antes de atingirem o substrato. Isso cria partículas que podem causar defeitos ou formar um filme pulverulento de baixa densidade, em vez de um filme denso e de alta qualidade.
O Papel dos Parâmetros do Processo
Os engenheiros usam vários parâmetros-chave como alavancas para controlar a cinética e a localização da reação:
- Temperatura: Aumenta as taxas de reação, mas também pode aumentar as reações indesejadas na fase gasosa.
- Pressão: Afeta a concentração dos reagentes e a rapidez com que eles viajam para a superfície.
- Proporções de Gás: Ditata a estequiometria e controla qual via de reação é favorecida.
Equilibrar esses fatores é crucial para promover um crescimento limpo e heterogêneo na superfície do substrato.
Otimizando Reações para o Seu Filme Desejado
A via de reação química específica que você emprega é determinada inteiramente pelo material que você pretende criar.
- Se o seu foco principal é depositar um elemento puro (por exemplo, Tungstênio, Silício): Você provavelmente dependerá da decomposição térmica ou de uma reação de redução de hidrogênio usando um único precursor e possivelmente um agente redutor.
- Se o seu foco principal é criar um óxido ou nitreto composto (por exemplo, SiO₂, TiN): Você usará uma reação de síntese ou oxidação, introduzindo um agente oxidante ou nitretante junto com o seu precursor principal.
- Se o seu foco principal é minimizar defeitos e obter um filme de alta qualidade: Sua principal tarefa é ajustar a temperatura e a pressão para suprimir as reações homogêneas na fase gasosa e promover um crescimento limpo e heterogêneo no substrato.
Em última análise, dominar o CVD é dominar a arte de direcionar a química para ocorrer em um tempo e lugar específicos.
Tabela Resumo:
| Tipo de Reação | Processo Químico Chave | Exemplo de Reação | Caso de Uso Comum |
|---|---|---|---|
| Decomposição Térmica (Pirólise) | Precursor único se decompõe via calor | SiH₄ (gás) → Si (sólido) + 2H₂ (gás) | Deposição de elementos puros como polissilício |
| Redução Química | Precursor reage com um agente redutor (por exemplo, H₂) | WF₆ (gás) + 3H₂ (gás) → W (sólido) + 6HF (gás) | Filmes metálicos de alta pureza (por exemplo, tungstênio) |
| Oxidação | Precursor reage com um agente oxidante (por exemplo, O₂) | SiH₄ (gás) + O₂ (gás) → SiO₂ (sólido) + 2H₂ (gás) | Camadas dielétricas como dióxido de silício |
| Síntese/Combinação | Múltiplos precursores se combinam para formar um composto | 3SiH₄ (gás) + 4NH₃ (gás) → Si₃N₄ (sólido) + 12H₂ (gás) | Materiais complexos como nitreto de silício |
Pronto para otimizar seu processo CVD com reações controladas com precisão? A KINTEK é especializada em equipamentos de laboratório e consumíveis para aplicações CVD, ajudando você a obter filmes finos sem defeitos através de soluções de reator personalizadas. Seja para depositar metais, óxidos ou nitretos, nossa experiência garante crescimento de superfície superior e defeitos minimizados na fase gasosa. Entre em contato conosco hoje para discutir como nossos sistemas CVD podem aprimorar seus resultados de deposição de materiais!
Guia Visual
Produtos relacionados
- Equipamento de Forno Tubular de Deposição Química de Vapor Aprimorada por Plasma Inclinado PECVD
- Equipamento de Sistema de Máquina HFCVD para Revestimento de Nano-Diamante em Matriz de Trefilação
- 915MHz MPCVD Máquina de Diamante Sistema de Reator de Deposição Química de Vapor de Plasma de Micro-ondas
- Máquina de Forno de Prensagem a Quente a Vácuo para Laminação e Aquecimento
- Materiais de Diamante Dopado com Boro CVD Laboratório
As pessoas também perguntam
- Como são depositados os filmes finos? Um Guia para Métodos PVD vs. CVD para Sua Aplicação
- Por que uma Rede de Casamento é Indispensável em RF-PECVD para Filmes de Siloxano? Garante Plasma Estável e Deposição Uniforme
- Qual é a diferença entre PECVD e APCVD? Escolha o Método CVD Certo para Sua Aplicação
- Quais são as capacidades de processo dos sistemas ICPCVD? Obtenha deposição de filme de baixo dano em temperaturas ultrabaixas
- O CVD assistido por plasma pode depositar metais? Por que o PECVD é raramente usado para deposição de metais



















