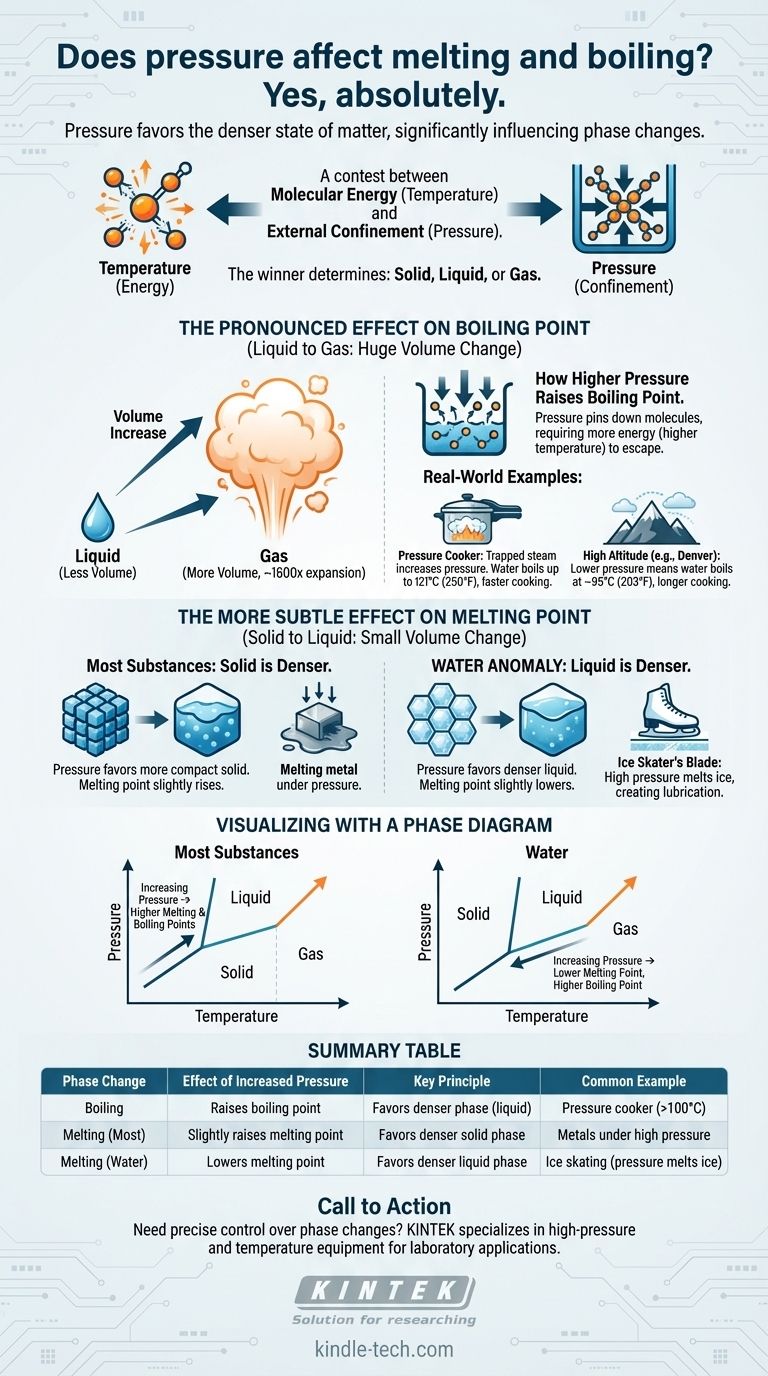
Sim, absolutamente. A pressão é um fator crítico que influencia diretamente as temperaturas nas quais as substâncias mudam de fase. O aumento da pressão externa geralmente eleva significativamente o ponto de ebulição de um líquido. Seu efeito no ponto de fusão é mais sutil, mas segue um princípio claro: a pressão favorece o estado da matéria mais denso.
O princípio central é uma disputa entre a energia molecular (temperatura) e o confinamento externo (pressão). A temperatura dá às moléculas a energia para se libertarem para um estado menos ordenado, enquanto a pressão as força a se unirem em um estado mais compacto e denso. O vencedor desta disputa determina se uma substância é sólida, líquida ou gasosa.

Por Que a Pressão Influencia as Mudanças de Fase
A Batalha Entre Energia e Confinamento
Uma mudança de fase, como fusão ou ebulição, ocorre quando as moléculas ganham energia térmica suficiente para superar as forças que as mantêm em uma estrutura fixa. A temperatura fornece essa energia.
A pressão, por outro lado, é uma força externa que empurra as moléculas para mais perto umas das outras. Ela atua como uma forma de confinamento, tornando mais difícil para as moléculas se espalharem e fazerem a transição para uma fase menos densa.
Uma Questão de Volume e Densidade
A chave para entender o efeito da pressão reside no volume. Quando uma substância derrete ou ferve, seu volume e densidade mudam.
A pressão sempre favorecerá a fase que ocupa menos volume — a fase mais densa. Esta única regra explica por que a pressão afeta a ebulição e a fusão de forma diferente.
O Efeito Pronunciado no Ponto de Ebulição
Do Líquido ao Gás: Uma Grande Mudança de Volume
A transição de um líquido para um gás envolve um aumento massivo de volume. Uma única gota de água, por exemplo, expande-se para preencher um espaço mais de 1.600 vezes maior quando se torna vapor.
Como essa mudança de volume é tão grande, a pressão tem um impacto muito forte e direto no ponto de ebulição.
Como a Pressão Mais Alta Aumenta o Ponto de Ebulição
Quando você aumenta a pressão na superfície de um líquido, você está essencialmente "prendendo" as moléculas. Elas agora exigem significativamente mais energia cinética (uma temperatura mais alta) para escapar para a fase gasosa.
É por isso que o ponto de ebulição de quase todas as substâncias aumenta à medida que a pressão aumenta.
Exemplo do Mundo Real: A Panela de Pressão
Uma panela de pressão funciona vedando uma panela, retendo o vapor produzido pela água fervente. Esse vapor retido aumenta drasticamente a pressão interna.
Sob essa alta pressão, o ponto de ebulição da água pode subir de 100°C (212°F) para até 121°C (250°F). Essa água mais quente transfere calor mais rapidamente, reduzindo drasticamente os tempos de cozimento.
Exemplo do Mundo Real: Cozinhar em Alta Altitude
O oposto ocorre em altas altitudes. Em Denver, Colorado (a 5.280 pés), a pressão atmosférica é menor.
Com menos pressão atmosférica segurando as moléculas de água, elas podem escapar para a fase gasosa mais facilmente. A água lá ferve a cerca de 95°C (203°F), o que significa que os alimentos devem ser cozidos por mais tempo.
O Efeito Mais Sutil no Ponto de Fusão
Do Sólido ao Líquido: Uma Pequena Mudança de Volume
Em contraste com a ebulição, a mudança de volume durante a fusão é muito pequena. As densidades de uma substância em suas formas sólida e líquida são geralmente bastante semelhantes.
Como a mudança de volume é mínima, a pressão tem um efeito muito menos dramático no ponto de fusão.
Para a Maioria das Substâncias: Pressão Mais Alta Aumenta o Ponto de Fusão
A maioria dos materiais — de metais a ceras e dióxido de carbono — é mais densa em sua forma sólida do que em sua forma líquida.
Nesses casos, o aumento da pressão favorece a fase sólida mais compacta. Isso torna um pouco mais difícil derreter, então uma temperatura mais alta é necessária. O ponto de fusão aumenta com a pressão.
A Anomalia da Água: Uma Exceção Crucial
A água é uma exceção notável e rara. A água sólida (gelo) é menos densa que a água líquida, razão pela qual o gelo flutua.
Como a água líquida é a fase mais densa, o aumento da pressão sobre o gelo favorece a formação de líquido. Isso significa que, sob alta pressão, o gelo derreterá a uma temperatura abaixo de 0°C (32°F).
Exemplo do Mundo Real: A Lâmina do Patinador no Gelo
A ilustração clássica desse princípio é um patinador no gelo. A lâmina fina do patim concentra todo o peso do patinador em uma área minúscula, criando uma pressão imensa sobre o gelo.
Essa alta pressão faz com que o gelo diretamente sob a lâmina derreta a uma temperatura ligeiramente mais baixa, criando uma camada microscópica de água que lubrifica o caminho da lâmina.
Compreendendo as Trocas: Visualizando com um Diagrama de Fases
Um diagrama de fases é um mapa simples que mostra o estado de uma substância (sólido, líquido ou gás) em qualquer combinação de temperatura e pressão.
A Fronteira Líquido-Gás
A linha que separa as fases líquida e gasosa sempre sobe e vai para a direita. Isso confirma visualmente que, ao aumentar a pressão (movendo-se para cima no eixo vertical), você também deve aumentar a temperatura (movendo-se para a direita no eixo horizontal) para fazer a substância ferver.
A Fronteira Sólido-Líquido
A linha entre as fases sólida e líquida é quase vertical, mostrando que a pressão tem uma influência muito menor na fusão.
Para a maioria das substâncias, essa linha se inclina ligeiramente para a direita (pressão mais alta, ponto de fusão mais alto). Para a água, essa linha se inclina unicamente para a esquerda, mostrando que uma pressão mais alta leva a um ponto de fusão mais baixo.
Princípios Chave para Aplicação Prática
Para aplicar esse conhecimento de forma eficaz, concentre-se na substância e no tipo de mudança de fase envolvida.
- Se você está lidando com ebulição ou condensação: Lembre-se de que a pressão é o fator dominante. Pressão mais alta significa um ponto de ebulição mais alto, e pressão mais baixa significa um ponto de ebulição mais baixo.
- Se você está lidando com fusão ou congelamento (para a maioria dos materiais): O efeito da pressão é menor. Uma pressão mais alta aumentará ligeiramente o ponto de fusão, favorecendo o estado sólido mais denso.
- Se você está lidando especificamente com gelo de água: Lembre-se de que é a exceção. Uma pressão mais alta diminui o ponto de congelamento/fusão, favorecendo o estado líquido mais denso.
Compreender como a pressão e a temperatura interagem lhe dá controle direto sobre o estado físico da matéria.
Tabela Resumo:
| Mudança de Fase | Efeito do Aumento da Pressão | Princípio Chave | Exemplo Comum |
|---|---|---|---|
| Ebulição | Aumenta o ponto de ebulição | Favorece a fase mais densa (líquido) | Panela de pressão (água ferve >100°C) |
| Fusão (Maioria dos Materiais) | Aumenta ligeiramente o ponto de fusão | Favorece a fase sólida mais densa | Metais sob alta pressão |
| Fusão (Água/Gelo) | Diminui o ponto de fusão | Favorece a fase líquida mais densa | Patinação no gelo (pressão derrete o gelo) |
Precisa de controle preciso sobre as mudanças de fase em seus processos de laboratório? A KINTEK é especializada em equipamentos de alta pressão e temperatura para aplicações laboratoriais. Seja desenvolvendo novos materiais, realizando síntese química ou estudando o comportamento de fases, nossos reatores e fornos fornecem o controle exato de pressão e temperatura de que você precisa. Entre em contato com nossos especialistas hoje para discutir como nossas soluções podem aumentar a eficiência e precisão de sua pesquisa.
Guia Visual
Produtos relacionados
- Reatores de Alta Pressão Personalizáveis para Aplicações Científicas e Industriais Avançadas
- Mini Reator Autoclave de Alta Pressão SS para Uso em Laboratório
- Reator Autoclave de Laboratório de Alta Pressão para Síntese Hidrotermal
- Reator Autoclavado de Alta Pressão em Aço Inoxidável Reator de Pressão Laboratorial
- Fornalha de Tubo a Vácuo de Alta Pressão de Laboratório
As pessoas também perguntam
- Que papéis os autoclaves desempenham na síntese de zeólitos MFI? Domine o Crescimento Cristalino Hidrotérmico
- Qual é a contribuição de um reator hidrotermal para a construção de poros graduados? Modelos de Precisão para TAS
- Qual papel um autoclave desempenha na simulação das condições de PWR? Validação Avançada de Materiais para Segurança Nuclear
- Por que os autoclaves de alta pressão são essenciais para a preparação de agentes de cura de poliamida de base biológica a partir de ácido dimérico?
- Qual é o propósito de usar um reator hidrotermal de alta temperatura? Melhorar a Síntese de Cátodos de Iodo@Carvão Ativado



















