Definição e funções básicas da célula electrolítica
Índice
Compreender o papel da energia eléctrica e da energia química numa célula electrolítica
Célula eletroquímica Uma célula eletroquímica é um dispositivo capaz de gerar energia eléctrica a partir de reacções químicas ou de facilitar reacções químicas através da introdução de energia eléctrica.
Definir eletroquímica A eletroquímica é o estudo dos processos químicos que provocam o movimento dos electrões. Trata da interação entre a energia eléctrica e a mudança química.
Exemplo: O estudo das células electroquímicas faz parte da eletroquímica. Trata-se de células que convertem energia química em energia eléctrica.
Importância da eletroquímica A eletroquímica trata das relações entre os fenómenos eléctricos e químicos. Os processos electroquímicos são utilizados em vários ramos da indústria. É o processo mais importante para a produção de vários produtos químicos. A produção de vários metais é baseada no método eletroquímico. O hidrogénio é produzido pela eletrólise da água. Desempenha também um papel importante no desenvolvimento do automóvel elétrico.
Descrição dos componentes de uma célula electrolítica, incluindo eléctrodos e eletrólito
As células electrolíticas são constituídas por 3 componentes essenciais.

O ânodo é o elétrodo negativo ou redutor que liberta electrões para o circuito externo e se oxida durante uma reação eletroquímica.
O cátodo é o elétrodo positivo ou oxidante que adquire electrões do circuito externo e é reduzido durante a reação eletroquímica.
O eletrólito é o meio que proporciona o mecanismo de transporte de iões entre o cátodo e o ânodo de uma célula. Os electrólitos são frequentemente considerados como líquidos, como a água ou outros solventes, com sais dissolvidos, ácidos ou álcalis que são necessários para a condução iónica. No entanto, deve notar-se que muitas pilhas, incluindo as pilhas convencionais (AA/AAA/D), contêm electrólitos sólidos que actuam como condutores iónicos à temperatura ambiente.
Considerações sobre a seleção do cátodo, do ânodo e do eletrólito
As propriedades desejáveis dos materiais do ânodo, do cátodo e do eletrólito são indicadas a seguir.
Explicação do processo de transferência de carga entre eléctrodos e iões
Célula electrolítica, qualquer dispositivo no qual a energia eléctrica é convertida em energia química, ou vice-versa. Uma célula deste tipo é normalmente constituída por dois condutores metálicos ou electrónicos (eléctrodos) afastados um do outro e em contacto com um eletrólito (q.v.), geralmente um composto iónico dissolvido ou fundido. A ligação dos eléctrodos a uma fonte de corrente eléctrica contínua torna um deles carregado negativamente e o outro carregado positivamente. Os iões positivos do eletrólito migram para o elétrodo negativo (cátodo) e aí combinam-se com um ou mais electrões, perdendo parte ou a totalidade da sua carga e transformando-se em novos iões com menor carga ou em átomos ou moléculas neutras; ao mesmo tempo, os iões negativos migram para o elétrodo positivo (ânodo) e transferem um ou mais electrões para este, transformando-se também em novos iões ou partículas neutras. O efeito global dos dois processos é a transferência de electrões dos iões negativos para os iões positivos, uma reação química (ver reação de oxidação-redução). Um exemplo é a eletrólise do cloreto de sódio (sal comum), formando sódio metálico e cloro gasoso; a energia necessária para que a reação se processe é fornecida pela corrente eléctrica. Outras aplicações comuns da eletrólise incluem a eletrodeposição para refinação ou revestimento de metais e a produção de soda cáustica.
O que é uma célula electrolítica? Uma célula electrolítica pode ser definida como um dispositivo eletroquímico que utiliza energia eléctrica para facilitar uma reação redox não espontânea. As células electrolíticas são células electroquímicas que podem ser utilizadas para a eletrólise de determinados compostos. Por exemplo, a água pode ser submetida a eletrólise (com a ajuda de uma célula electrolítica) para formar oxigénio gasoso e hidrogénio gasoso. Isto é feito utilizando o fluxo de electrões (para o meio reacional) para ultrapassar a barreira da energia de ativação da reação redox não espontânea.


Os três componentes principais das células electrolíticas são: Cátodo (que é carregado negativamente nas células electrolíticas) Ânodo (que é carregado positivamente nas células electrolíticas) Eletrólito O eletrólito fornece o meio para a troca de electrões entre o cátodo e o ânodo. Os electrólitos habitualmente utilizados nas células electrolíticas incluem a água (que contém iões dissolvidos) e o cloreto de sódio fundido.
CÉLULAS ELECTRÓLICAS Para definir células electrolíticas, é necessário compreender primeiro a eletrólise. A eletrólise é um método que consiste em fazer passar uma corrente eléctrica através de um líquido contendo iões, provocando a desintegração dos compostos no seu interior. Este método é utilizado para isolar o metal dos elementos metálicos, segregar outras substâncias químicas (como a água), electrodepositar metais e recarregar baterias. Um circuito completo é essencial para manter um processo eletrolítico; temos de ser capazes de retirar eletricidade da célula continuamente.
O cátodo e o ânodo de uma célula electrolítica estão ligados a uma fonte de energia. Estes dois eléctrodos estáveis e uma solução electrolítica fluida encontram-se em todas as células electrolíticas. A solução electrolítica conduz eletricidade, uma vez que os iões dissolvidos podem mover-se livremente na solução.
Célula electrolítica e seus componentes A célula electrolítica é constituída por três componentes principais - bateria, eléctrodos e eletrólito. Bateria A bateria funciona como fonte de energia. Fornece a energia eléctrica para provocar a alteração química, ou seja, a decomposição do composto iónico. Eléctrodos Os eléctrodos são contactos eléctricos que fecham ou completam o circuito elétrico entre os fios e o eletrólito. Exemplos de eléctrodos incluem varetas de carbono (grafite) e placas de metal. O elétrodo à esquerda (ver imagem acima) que está ligado ao terminal positivo da pilha é o elétrodo positivo ou ânodo. O elétrodo à direita, que está ligado ao terminal negativo da pilha, é o elétrodo negativo ou cátodo. Eletrólito O eletrólito é uma substância que contém iões móveis quando fundidos ou em solução aquosa, para conduzir eletricidade. Exemplos de electrólitos incluem cloreto de sódio fundido, solução de sulfato de cobre(II) e ácidos, como o ácido clorídrico diluído. Exemplos de não electrólitos incluem a solução de açúcar, o etanol e o enxofre (fundido), uma vez que se trata de líquidos ou soluções que não contêm iões móveis para conduzir eletricidade.

Aplicações As células electrolíticas são frequentemente utilizadas para decompor compostos químicos, num processo designado por eletrólise - com electro a significar eletricidade e a palavra grega lysis a significar quebrar. Exemplos importantes de eletrólise são a decomposição da água em hidrogénio e oxigénio, e da bauxite em alumínio e outros produtos químicos. A galvanoplastia (por exemplo, de cobre, prata, níquel ou crómio) é feita utilizando uma célula electrolítica. A eletrólise é uma técnica que utiliza uma corrente eléctrica direta (CC).
Comercialmente, as células electrolíticas são utilizadas na electrorefinação e electrolavagem de vários metais não ferrosos. A maior parte do alumínio, cobre, zinco e chumbo de elevada pureza são produzidos industrialmente em células electrolíticas.
Uma célula electrolítica Os três componentes das células electrolíticas são um eletrólito e dois eléctrodos.
Electrólitos Os electrólitos são as substâncias que dão origem a uma solução condutora de eletricidade quando dissolvidas em solventes polares, como a água. Isto acontece porque quando o eletrólito é dissolvido nos solventes polares, divide-se em catiões e aniões e distribui-se uniformemente pela solução. Estes catiões e aniões sob um potencial elétrico na solução deslocam-se para o elétrodo com uma abundância de electrões e um défice de electrões, respetivamente. Este movimento de catiões e aniões em sentido contrário gera corrente e forma as células electrolíticas.
Enquanto os sais, ácidos e bases formam um eletrólito, alguns gases, em determinadas condições, podem também comportar-se como um eletrólito, como o cloreto de hidrogénio a alta temperatura e baixa pressão.
Reacções químicas em células electrolíticas
Explicação da reação de oxidação-redução numa célula electrolítica
Nas células electroquímicas, ocorrem reacções de oxidação-redução (redox). Existem dois tipos de células electroquímicas: as células galvânicas (voltaicas), onde ocorrem reacções espontâneas, e as células electrolíticas, onde ocorrem reacções não espontâneas.
Ambos os tipos de células têm eléctrodos onde ocorrem reacções de oxidação e redução. A oxidação ocorre no elétrodo chamado ânodo e a redução ocorre no elétrodo chamado cátodo.
Numa célula electrolítica, o ânodo é positivo e o cátodo é negativo. Isto deve-se ao facto de o ânodo atrair aniões da solução. Por outro lado, numa célula galvânica, o ânodo tem carga negativa, uma vez que a oxidação espontânea no ânodo é a fonte dos electrões ou da carga negativa da célula. O cátodo de uma célula galvânica é o seu terminal positivo.
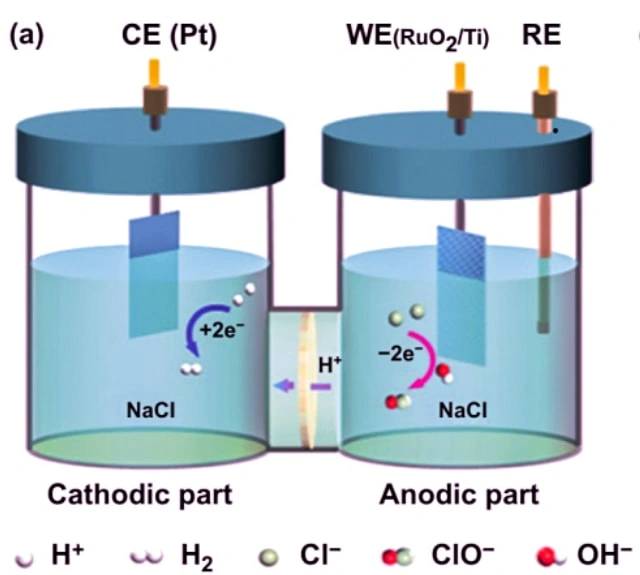
Exemplo de eletrólise do cloreto de sódio
Um exemplo de uma célula electrolítica é a eletrólise do cloreto de sódio. Quando o cloreto de sódio é dissolvido em água e sujeito a eletrólise, ocorrem as seguintes reacções:
No cátodo: 2 H2O + 2 e- -> 2 OH- + H2
No ânodo: 2 Cl- -> Cl2 + 2 e-
Reação global: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
Nesta célula electrolítica, dois eléctrodos inertes estão imersos em cloreto de sódio fundido. Quando uma corrente eléctrica passa pelo circuito, o cátodo torna-se rico em electrões e desenvolve uma carga negativa. Os iões de sódio com carga positiva são atraídos para o cátodo, resultando na formação de sódio metálico. Ao mesmo tempo, os átomos de cloro são atraídos para o ânodo carregado positivamente, levando à formação de cloro gasoso. O resultado global é a produção de sódio metálico, cloro gasoso e hidróxido de sódio aquoso.
Aplicações das células electrolíticas
As células electrolíticas têm várias aplicações:
- Produção de oxigénio gasoso e hidrogénio gasoso a partir da água.
- Extração de alumínio da bauxite.
- Eletrodeposição, que consiste na formação de uma fina camada protetora de um metal específico sobre a superfície de outro metal.
- Electrorrefinação de metais não ferrosos.
- Processos de recuperação electrolítica.
- A produção industrial de cobre de alta pureza, zinco de alta pureza e alumínio de alta pureza é quase sempre feita através de células electrolíticas.
![Diagrama esquemático de uma célula electrolítica com cátodo HER e ânodo ClER]()
Aplicação de células electrolíticas (zinco de elevada pureza, alumínio de elevada pureza, cobre de elevada pureza)
As células electrolíticas desempenham um papel crucial em várias indústrias e processos, permitindo a produção de produtos químicos e materiais importantes.
Aplicações da eletrólise
Utilização da eletrólise na eletrodeposição para refinação ou revestimento de metais
A eletrólise é amplamente utilizada no processo de eletrodeposição para refinação ou revestimento de metais. Uma aplicação prática da eletrólise neste contexto é a electro-limpeza. Na electro-limpeza, o artigo a ser limpo, como o zinco ou o alumínio, é transformado no cátodo e é passada uma corrente forte através de uma solução electrolítica. A soda cáustica e o hidrogénio são produzidos no cátodo, o que remove eficazmente a gordura e as impurezas da superfície do artigo. Este processo pode ser utilizado para refinar ou revestir metais, proporcionando um aspeto limpo e brilhante, protegendo contra a corrosão e substituindo materiais desgastados.
Produção de soda cáustica por eletrólise
Outra aplicação significativa da eletrólise é a produção de produtos químicos, incluindo soda cáustica (NaOH) e cloro gasoso, em grande escala. Neste processo, a eletrólise é utilizada para decompor o cloreto de sódio (NaCl) nos seus elementos constituintes, o sódio (Na) e o cloro (Cl2). A reação no cátodo envolve a redução dos iões de sódio (Na+) a sódio metálico (Na), enquanto no ânodo os iões de cloreto (Cl-) são oxidados para formar cloro gasoso (Cl2). A reação global da célula é 2NaCl → 2Na + Cl2. Através deste processo eletrolítico, podem ser produzidas grandes quantidades de soda cáustica e de cloro gasoso para diversas aplicações industriais.
A eletrólise na extração de metais
A eletrólise desempenha um papel crucial na extração de metais dos seus minérios. Existem dois métodos principais de extração de metais por eletrólise. No primeiro método, o minério é tratado com um ácido forte para obter um sal, e a solução salina resultante é electrolisada para libertar o metal. No segundo método, o minério encontra-se em estado fundido e é diretamente electrolisado num forno.
Um exemplo de extração de metal por eletrólise é a extração de zinco. O minério de zinco é tratado com ácido sulfúrico para formar uma solução de sulfato de zinco, que é depois electrolisada. No tanque eletrolítico, são utilizados cátodos de alumínio e ânodos de chumbo. O zinco é depositado nos cátodos, enquanto o ácido sulfúrico é regenerado nos ânodos. Este processo eletrolítico permite a extração de zinco de elevada pureza.

zinco e alumínio
Em geral, a eletrólise encontra aplicações práticas em várias indústrias para a extração, refinação e revestimento de metais, bem como para a produção de produtos químicos como a soda cáustica. Ao aproveitar o poder da eletrólise, as empresas podem obter resultados de alta qualidade e satisfazer as exigências das respectivas indústrias.
Conversão de energia química em eletricidade
Explicação da produção de energia em reacções que envolvem substâncias que geram energia
Nas células electroquímicas, a energia química é convertida em energia eléctrica através de um processo denominado eletrólise. A eletrólise é uma reação redox que ocorre numa célula eletroquímica, onde as substâncias químicas são decompostas nos eléctrodos. Os produtos da eletrólise dependem do tipo de elétrodo e do eletrólito utilizado na célula. Este processo é a base de várias aplicações em eletroquímica.
O campo da eletroquímica envolve a produção de eletricidade a partir da energia libertada durante as reacções químicas espontâneas, bem como a utilização de energia eléctrica para impulsionar alterações químicas não espontâneas. As reacções redox, que envolvem a transferência de electrões entre espécies, estão no centro destes processos. Muitas reacções químicas e biológicas são reacções redox e desempenham um papel crucial na obtenção de energia para fins domésticos, de transporte ou industriais.
A energia gerada nestas reacções é utilizada numa vasta gama de aplicações, incluindo a queima de combustível para a digestão de alimentos em animais, processos industriais, fotossíntese, extração de metais de minérios, fabrico de produtos químicos importantes e funcionamento de baterias e células de combustível.
Exemplo de uma pilha de chumbo-ácido

Baterias de chumbo-ácido
A bateria de chumbo-ácido funciona como uma célula electrolítica e como uma célula galvânica. Quando descarregada, actua como uma célula galvânica, convertendo energia química em energia eléctrica. Durante o processo de descarga, o dióxido de chumbo, o chumbo metálico e o ácido sulfúrico reagem para formar sulfato de chumbo e água. A oxidação do chumbo em sulfato de chumbo ocorre num elétrodo, enquanto a redução do dióxido de chumbo em sulfato de chumbo ocorre no outro elétrodo. A carga eléctrica é transportada através do eletrólito pela migração de iões de hidrogénio.
Esta separação dos processos de oxidação e redução cria uma força motriz, ou uma tensão, que faz com que a eletricidade flua através de um circuito externo que liga os dois eléctrodos. Muitas outras combinações químicas têm sido utilizadas em células e baterias, cada uma com as suas próprias reacções e características específicas.
Pilhas de combustível
As células de combustível são outro tipo de célula eletroquímica que converte a energia química do combustível em eletricidade. Estas células funcionam através de uma reação eletroquímica entre o hidrogénio combustível e um agente oxidante, normalmente o oxigénio. Ao contrário das baterias, que geram energia a partir de substâncias químicas já presentes no seu interior, as células de combustível requerem um fluxo contínuo de oxigénio e um fornecimento de combustível para gerar eletricidade.

A pilha de combustível
Em resumo, a conversão de energia química em eletricidade é um processo fundamental da eletroquímica. Ocorre através de reacções redox em células electroquímicas, como as baterias de chumbo-ácido e as células de combustível. Estas tecnologias têm várias aplicações, desde a alimentação de veículos até à produção de eletricidade para a exploração espacial.
Células alternativas para a produção de eletricidade
- Compreender as células solares e o papel dos semicondutores e da absorção de luz
- O silício amorfo (A-Si) é um material fotovoltaico de película fina dominante que tem uma capacidade de absorção de luz cerca de 40 vezes superior à do silício cristalino.
- O telureto de cádmio (CdTe) é outro material de película fina com elevada capacidade de absorção de luz. Pode absorver 90% do espetro solar com uma película fina de apenas 1 mm.

Silício amorfo, telureto de cádmio, disseleneto de cobre e índio
- Explicação das células de combustível e da sua utilização de agentes oxidantes e agentes redutores
- As pilhas de combustível são células electroquímicas que reagem o hidrogénio combustível com o oxigénio ou outro agente oxidante para converter a energia química em eletricidade.
- São diferentes das pilhas, uma vez que requerem uma fonte contínua de combustível e oxigénio para sustentar a reação química.
- As células de combustível podem produzir eletricidade continuamente, desde que o combustível e o oxigénio sejam fornecidos.
- São utilizadas para energia primária e de reserva em várias aplicações, incluindo edifícios comerciais, industriais, residenciais e áreas remotas.
- As pilhas de combustível são também utilizadas para alimentar veículos movidos a pilhas de combustível, como empilhadores, automóveis, autocarros, barcos, motociclos e submarinos.
Espera-se que o mercado global de células de combustível aumente 19,9% até 2030.
- Outras células para produção de eletricidade
- As células solares geram eletricidade através da absorção de luz por semicondutores.
- As pilhas de combustível utilizam a energia química do combustível para gerar eletricidade.
- As pilhas recarregáveis podem ser utilizadas várias vezes através do seu recarregamento.
- As células não recarregáveis não podem ser reutilizadas e têm de ser eliminadas.
- As baterias de chumbo-ácido/armazenamento de chumbo são células secundárias utilizadas como fonte de energia em veículos.
As células de película fina, como as células solares de película fina, os transístores de película fina e as baterias de película fina, oferecem uma maior eficiência, um carregamento mais rápido e um tempo de vida mais longo do que as células convencionais.
O campo das células alternativas para a produção de eletricidade está em constante evolução. Os investigadores continuam a melhorar a eficiência e as propriedades dos materiais de película fina, enquanto os especialistas da indústria trabalham para reduzir os custos e aumentar a produção.Se estiver interessado neste produto, pode consultar o sítio Web da nossa empresa:https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple
Produtos relacionados
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletroquímica de Eletrólise Espectral de Camada Fina
- Banho de Água de Célula Eletroquímica Eletrolítica Multifuncional Camada Única Dupla Camada
- Eletrodo de Chapa de Platina para Aplicações Laboratoriais e Industriais
Artigos relacionados
- Superar os desafios do funcionamento das células electrolíticas do tipo H
- A Variável Invisível: Dominando a Inspeção da Célula Eletrolítica
- O Diálogo Silencioso: Dominando o Controle em Células Eletrolíticas
- Compreender as Células Electrolíticas de Quartzo: Aplicações, mecanismos e vantagens
- Eletroquímica A ciência por detrás das células electroquímicas

















