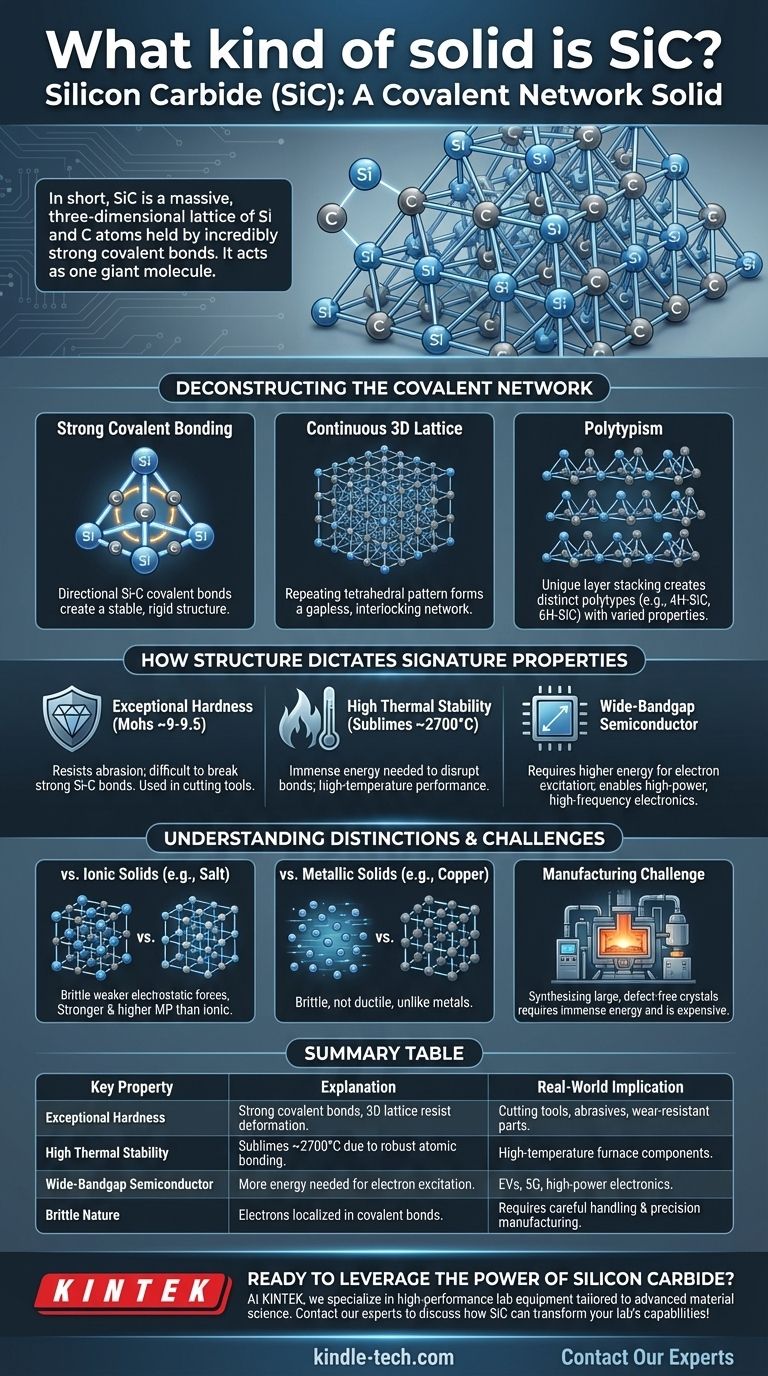
Em resumo, o Carboneto de Silício (SiC) é um sólido de rede covalente. Esta classificação significa que seus átomos de silício e carbono estão presos em uma vasta rede tridimensional mantida unida por ligações covalentes extremamente fortes e direcionais. Ao contrário dos sólidos moleculares com forças fracas entre as moléculas, o cristal inteiro de SiC atua efetivamente como uma única e gigante molécula.
A classificação do SiC como um sólido de rede covalente não é apenas um rótulo; é a explicação fundamental para suas propriedades excepcionais. Compreender sua rede atômica rígida é a chave para entender sua extrema dureza, estabilidade em altas temperaturas e comportamento eletrônico único.

Desconstruindo a Estrutura de Rede Covalente
Para entender o SiC, você deve primeiro visualizar sua arquitetura atômica subjacente. É essa estrutura que dita quase todas as suas características úteis.
A Natureza da Ligação Covalente no SiC
O Carboneto de Silício é formado por átomos de silício (Si) e carbono (C). Esses dois elementos têm uma diferença relativamente pequena de eletronegatividade, fazendo com que compartilhem elétrons e formem ligações covalentes muito fortes e estáveis.
Essas ligações são altamente direcionais. Cada átomo de carbono está ligado a quatro átomos de silício, e cada átomo de silício está ligado a quatro átomos de carbono em um arranjo tetraédrico rígido.
Uma Rede Contínua 3D
Esse padrão de ligação tetraédrica se repete infinitamente em todas as três dimensões. Isso cria uma rede contínua e interligada, sem pontos fracos ou moléculas individuais.
Pense nisso como uma estrutura semelhante ao diamante, mas com átomos alternados de silício e carbono em vez de apenas carbono. Essa estrutura rígida e sem lacunas é a fonte da imensa força física do SiC.
O Conceito de Polimorfismo
Uma característica única do SiC é o polimorfismo. Embora a ligação tetraédrica Si-C local seja constante, as camadas desses tetraedros podem ser empilhadas em diferentes sequências.
Esses diferentes arranjos de empilhamento criam estruturas cristalinas distintas chamadas politipos, como 4H-SiC e 6H-SiC. Embora todos sejam SiC, esses politipos têm propriedades eletrônicas ligeiramente diferentes, tornando-os adequados para diferentes aplicações semicondutoras.
Como a Estrutura Ditata as Propriedades Caracterísitcas do SiC
O modelo de rede covalente explica diretamente por que o SiC se comporta da maneira que o faz. As propriedades macroscópicas do material são uma consequência direta de sua ligação e estrutura microscópicas.
Dureza e Força Excepcionais
Para arranhar ou deformar o SiC, você deve quebrar fisicamente as poderosas ligações covalentes Si-C. Como o cristal inteiro é uma única rede dessas ligações, ele exibe uma incrível resistência à abrasão e deformação.
Na escala Mohs de dureza, o SiC (~9-9,5) é superado apenas pelo diamante (10), tornando-o um material de elite para ferramentas de corte, abrasivos e componentes resistentes ao desgaste.
Alta Estabilidade Térmica
Derreter ou quebrar um sólido requer fornecer energia suficiente aos seus átomos para superar as forças que os mantêm unidos. A imensa força das ligações covalentes Si-C significa que uma vasta quantidade de energia térmica é necessária para romper a rede.
Consequentemente, o SiC não derrete à pressão atmosférica, mas sublima (transforma-se diretamente em gás) em temperaturas extremamente altas, em torno de 2700 °C (4900 °F).
Comportamento Semicondutor Único
Embora as ligações fortes sejam características de um isolante elétrico como o diamante, a energia necessária para excitar um elétron para um estado condutor (o bandgap) no SiC é menor do que no diamante.
Isso coloca o SiC em uma categoria especial de semicondutores de banda larga. Seu bandgap é significativamente mais largo do que o do silício puro, permitindo que eletrônicos baseados em SiC operem em tensões, temperaturas e frequências muito mais altas.
Compreendendo as Vantagens e Distinções
Colocar o SiC em contexto com outros sólidos esclarece sua posição única. Suas propriedades são uma troca definida por sua ligação.
SiC vs. Sólidos Iônicos (por exemplo, Sal)
Sólidos iônicos como o cloreto de sódio (NaCl) são mantidos unidos por atração eletrostática não direcional entre íons positivos e negativos. Embora formem cristais, essas ligações são geralmente mais fracas do que as ligações covalentes do SiC, tornando-os mais macios e conferindo-lhes pontos de fusão muito mais baixos.
SiC vs. Sólidos Metálicos (por exemplo, Cobre)
Os metais são caracterizados por um "mar" de elétrons deslocalizados que cercam uma rede de íons positivos. Esse mar de elétrons permite que os metais sejam condutores e dúcteis (maleáveis). Em contraste, os elétrons do SiC estão presos em ligações covalentes localizadas, tornando-o um semicondutor e inerentemente frágil.
O Desafio da Fabricação
A própria força que torna o SiC tão desejável também o torna incrivelmente difícil de produzir. A síntese de grandes monocristais de SiC livres de defeitos requer imensa energia e processos sofisticados (como o método Lely), tornando-o significativamente mais caro do que o silício.
Fazendo a Escolha Certa para Sua Aplicação
A compreensão da classificação do SiC como um sólido de rede covalente permite prever seu comportamento e os melhores casos de uso.
- Se seu foco principal é o desempenho mecânico: Reconheça que sua rede covalente é a fonte direta de sua dureza e resistência ao desgaste de primeira linha, tornando-o ideal para abrasivos, jateamento de areia e vedações mecânicas duráveis.
- Se seu foco principal é a eletrônica de alta potência: Entenda que sua rede covalente cria um semicondutor de banda larga, essencial para a construção de inversores de energia robustos, carregadores de veículos elétricos e módulos de comunicação 5G que superam o silício.
- Se seu foco principal é a ciência dos materiais: Classifique o SiC como um sólido de rede covalente prototípico, usando-o como referência para dureza e estabilidade térmica ao comparar com outras cerâmicas avançadas como nitreto de boro ou nitreto de silício.
Em última análise, saber que o Carboneto de Silício é um sólido de rede covalente é o primeiro princípio para compreender e aplicar suas extraordinárias capacidades.
Tabela Resumo:
| Propriedade Chave | Explicação | Implicação no Mundo Real |
|---|---|---|
| Dureza Excepcional | Ligações covalentes fortes em uma rede 3D resistem à deformação. | Ideal para ferramentas de corte, abrasivos e peças resistentes ao desgaste. |
| Alta Estabilidade Térmica | Sublima a ~2700°C devido à robusta ligação atômica. | Adequado para aplicações de alta temperatura, como componentes de fornos. |
| Semicondutor de Banda Larga | Os elétrons requerem mais energia para excitar, permitindo operação de alta potência. | Usado em VEs, tecnologia 5G e eletrônica de potência para desempenho superior. |
| Natureza Frágil | Os elétrons são localizados em ligações covalentes, limitando a ductilidade. | Requer manuseio cuidadoso e processos de fabricação de precisão. |
Pronto para aproveitar o poder do Carboneto de Silício em seu laboratório? Na KINTEK, somos especializados em fornecer equipamentos e consumíveis de laboratório de alto desempenho, adaptados às necessidades avançadas da ciência dos materiais. Se você está desenvolvendo semicondutores de próxima geração ou precisa de componentes duráveis para processos de alta temperatura, nossa experiência garante que você obtenha as soluções certas para resultados superiores. Entre em contato com nossos especialistas hoje para discutir como o SiC pode transformar as capacidades do seu laboratório!
Guia Visual
Produtos relacionados
- Placa Cerâmica de Carboneto de Silício (SiC) Resistente ao Desgaste Engenharia Cerâmica Avançada Fina
- Elementos de Aquecimento Térmico de Carboneto de Silício SiC para Forno Elétrico
- Suportes Personalizados de PTFE para Laboratório e Processamento de Semicondutores
- Lente de Silício Monocristalino de Alta Resistência ao Infravermelho
- Peças Cerâmicas Avançadas de Nitreto de Boro (BN) para Engenharia de Precisão
As pessoas também perguntam
- Quais são as propriedades e aplicações da cerâmica de carbeto de silício? Resolva Desafios de Engenharia Extrema
- O carboneto de silício é melhor que a cerâmica? Descubra a Cerâmica Técnica Superior para a Sua Aplicação
- Qual é a resistividade do carboneto de silício? É uma propriedade ajustável, variando de <0,1 ohm-cm a altamente resistiva.
- Qual é mais duro, o carboneto de silício ou o carboneto de tungstênio? Descubra a chave para a seleção de materiais
- Quais são as propriedades do SiC? Desbloqueie o desempenho de alta temperatura e alta frequência



















