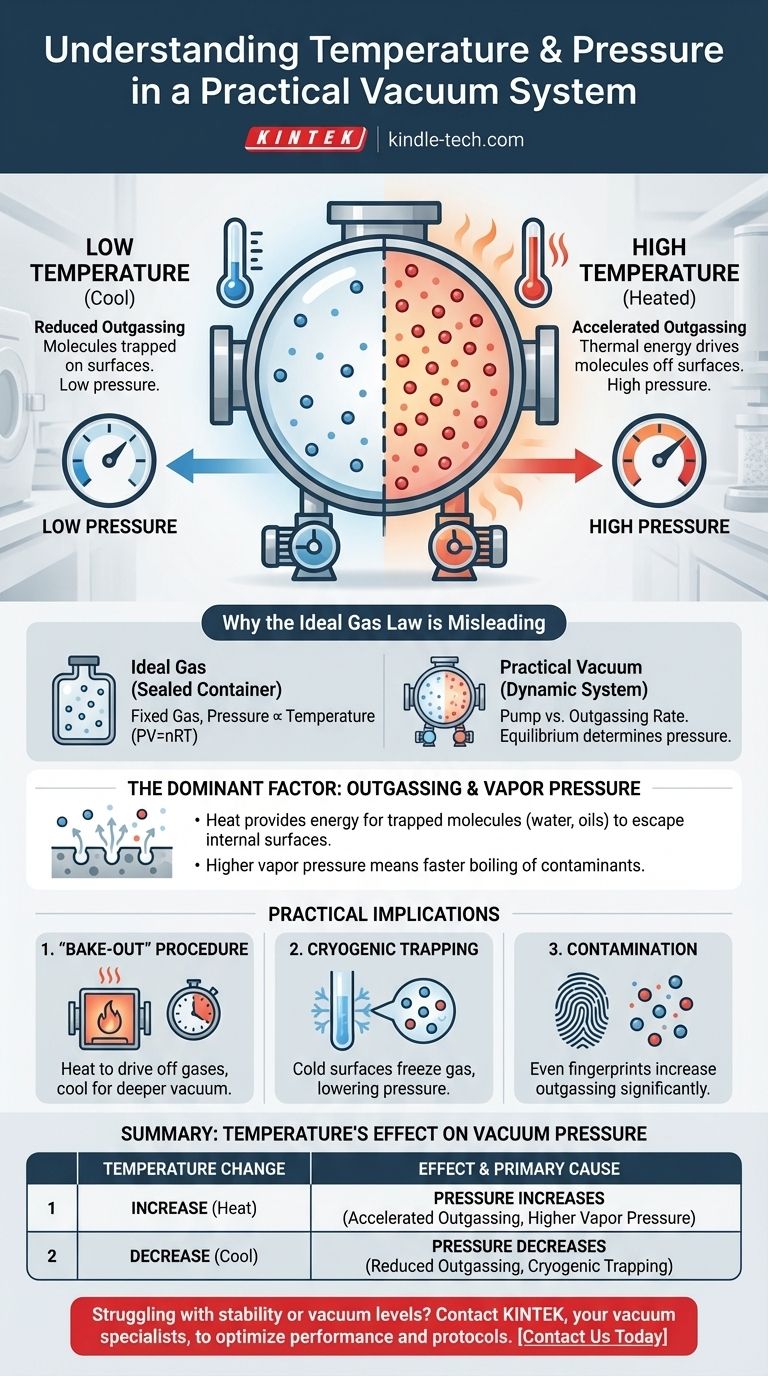
Em um sistema de vácuo prático, a relação é direta: aumentar a temperatura do sistema aumentará a pressão, degradando assim a qualidade do vácuo. Isso ocorre porque o calor fornece a energia para que as moléculas presas nas superfícies internas da câmara escapem para o espaço de vácuo. Este processo, conhecido como desgaseificação, é a fonte dominante de pressão em ambientes de alto vácuo.
A pressão dentro de uma câmara de vácuo do mundo real não é governada pela Lei dos Gases Ideais, mas pela taxa de desgaseificação de suas superfícies internas. Temperaturas mais altas aumentam essa taxa, liberando mais moléculas de gás e, consequentemente, aumentando a pressão geral.

Por Que a Lei dos Gases Ideais é Enganosa Aqui
A Concepção Errada de um "Gás Contido"
A familiar Lei dos Gases Ideais (PV=nRT) descreve a relação entre pressão, volume e temperatura para uma quantidade fixa de gás em um recipiente selado. Nesse cenário, a pressão é diretamente proporcional à temperatura.
Uma câmara de vácuo, no entanto, não é um recipiente selado com uma quantidade fixa de gás. É um sistema dinâmico onde uma bomba está removendo ativamente as moléculas.
A Realidade: Um Equilíbrio Dinâmico
A pressão em um vácuo é determinada pelo equilíbrio entre a taxa na qual a bomba remove as moléculas e a taxa na qual novas moléculas entram no sistema. A principal fonte dessas novas moléculas são as superfícies internas da própria câmara.
O Fator Dominante: Desgaseificação e Pressão de Vapor
O Que É Desgaseificação?
Todos os materiais possuem moléculas de gás adsorvidas (presas à superfície) ou absorvidas (presas dentro do material). Em um vácuo, essas moléculas escaparão gradualmente das superfícies.
Este processo é chamado de desgaseificação. O principal culpado na maioria dos sistemas de vácuo é o vapor de água, mas óleos, solventes e gases presos durante a fabricação também contribuem.
Como a Temperatura Impulsiona a Desgaseificação
Aquecer as paredes da câmara de vácuo transfere energia térmica para as moléculas presas. Essa energia aumentada permite que elas superem as forças que as prendem à superfície, fazendo com que sejam liberadas no vácuo.
Uma temperatura mais alta significa uma taxa significativamente maior de desgaseificação, o que leva diretamente a uma pressão mais alta.
O Papel da Pressão de Vapor
Para qualquer substância condensada, como uma gota de água ou uma película de óleo dentro da câmara, existe uma pressão de vapor. Esta é a pressão na qual a substância está em equilíbrio com seu próprio gás a uma dada temperatura.
À medida que a temperatura aumenta, a pressão de vapor desses contaminantes sobe exponencialmente. Se a pressão de vapor do contaminante exceder a pressão na câmara, ele irá evaporar rapidamente, causando um aumento dramático na pressão.
Compreendendo as Implicações Práticas
O Procedimento de "Bake-Out" (Cozimento)
Engenheiros exploram essa relação temperatura-pressão para atingir vácuo ultra-alto (UHV). Um sistema é aquecido, frequentemente a centenas de graus Celsius, por muitas horas ou dias enquanto as bombas estão funcionando.
Este "bake-out" acelera dramaticamente a desgaseificação, expelindo água presa e outros contaminantes para que as bombas possam removê-los permanentemente. Depois que o sistema é resfriado, a taxa de desgaseificação é vastamente menor, permitindo um vácuo muito mais profundo.
O Impacto da Criogenia
O efeito oposto também é usado. Superfícies extremamente frias, conhecidas como criotrapas ou criobombas, atuam como sumidouros para moléculas de gás.
Quando uma molécula como a água atinge uma superfície muito fria, ela congela instantaneamente e sua pressão de vapor se torna insignificante. Isso a remove efetivamente do vácuo, diminuindo dramaticamente a pressão do sistema.
O Problema da Contaminação
Este princípio destaca por que a limpeza é primordial na tecnologia de vácuo. Uma única impressão digital contém óleos e água que atuarão como uma fonte significativa de desgaseificação, limitando a pressão final que um sistema pode atingir, especialmente quando aquecido.
Fazendo a Escolha Certa para o Seu Objetivo
Para gerenciar eficazmente um sistema de vácuo, você deve tratar a temperatura como uma variável de controle primária.
- Se seu foco principal é atingir o vácuo mais profundo possível: Você deve aquecer a câmara em um "bake-out" enquanto bombeia para forçar a saída dos gases presos, e então permitir que ela esfrie para atingir a pressão alvo.
- Se seu foco principal é manter um vácuo estável durante um processo: Você deve garantir um controle preciso da temperatura, pois mesmo pequenas flutuações térmicas causarão mudanças de pressão devido às taxas de desgaseificação variáveis.
- Se seu foco principal é lidar com substâncias de alta pressão de vapor: Você pode precisar usar resfriamento criogênico (armadilhas frias) para capturar vapores e evitar que eles sobrecarreguem suas bombas.
Em última análise, dominar a pressão em seu sistema de vácuo significa dominar a energia térmica de suas superfícies.
Tabela Resumo:
| Mudança de Temperatura | Efeito na Pressão do Vácuo | Causa Principal |
|---|---|---|
| Aumento | Pressão Aumenta | Desgaseificação acelerada e maior pressão de vapor de contaminantes. |
| Diminuição | Pressão Diminui | Taxa de desgaseificação reduzida; superfícies criogênicas podem aprisionar moléculas. |
Com dificuldades com instabilidade de pressão ou incapaz de atingir seu nível de vácuo alvo? O gerenciamento térmico do seu sistema é provavelmente a chave. A KINTEK é especializada em equipamentos e consumíveis de laboratório para aplicações de vácuo precisas. Nossos especialistas podem ajudá-lo a selecionar os componentes certos e desenvolver protocolos para bake-out, controle de temperatura ou aprisionamento criogênico para garantir que seus processos de vácuo sejam confiáveis e repetíveis. Entre em contato com nossos especialistas em vácuo hoje para otimizar o desempenho do seu sistema.
Guia Visual
Produtos relacionados
- Máquina de Prensagem Hidráulica Aquecida com Placas Aquecidas para Prensa Quente de Laboratório com Caixa de Vácuo
- Prensa Térmica Hidráulica Elétrica a Vácuo para Laboratório
- Forno de Tratamento Térmico a Vácuo com Revestimento de Fibra Cerâmica
- Máquina de Prensagem Hidráulica Manual de Alta Temperatura com Placas Aquecidas para Laboratório
- Forno de Tratamento Térmico a Vácuo de Molibdênio
As pessoas também perguntam
- Por que o controle preciso de pressão através de um sistema hidráulico é necessário durante a prensagem a quente? Otimizar o desempenho do nanocopper
- Qual é o propósito de um sistema de prensagem a quente após a redução do pó de ferro em leito fluidizado? Estabilizar o ferro esponja
- Qual é o propósito de usar uma prensa hidráulica de laboratório para nanocompósitos? Garanta a Caracterização Precisa de Materiais
- Qual é a função de uma prensa hidráulica de laboratório de alta temperatura? Otimizar a Fabricação de MEA para Eletrólise de HCl
- Qual o papel de uma prensa hidráulica a quente de laboratório na fabricação de placas compósitas à base de casca de arroz? Alcançar Densidade Estrutural



















