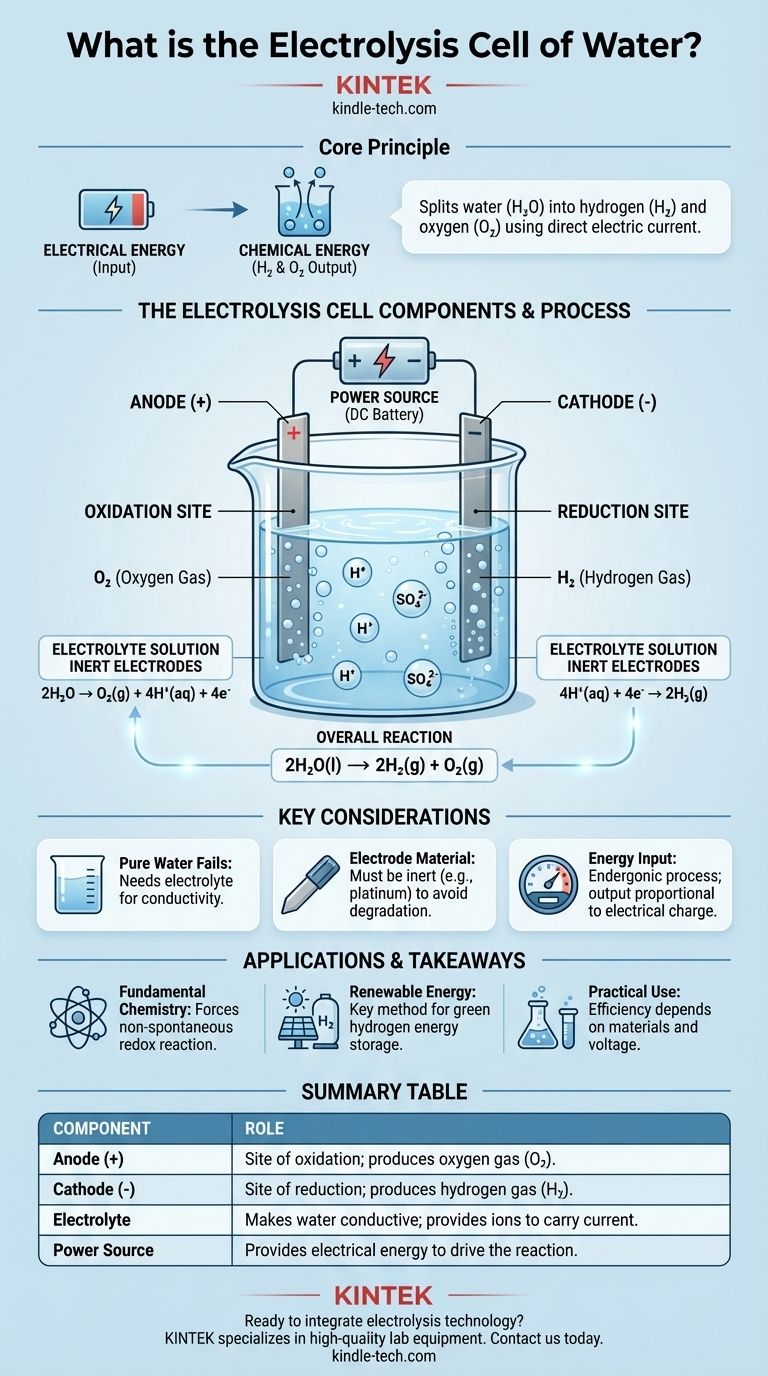
Na sua essência, uma célula de eletrólise da água é um dispositivo que utiliza energia elétrica para decompor a água (H₂O) nos seus elementos constituintes: gás hidrogénio (H₂) e gás oxigénio (O₂). Isto é conseguido ao passar uma corrente elétrica contínua através da água que contém uma pequena quantidade de um eletrólito, forçando uma alteração química que não ocorreria espontaneamente. Os componentes fundamentais são dois elétrodos (um ânodo e um cátodo) submersos no eletrólito e ligados a uma fonte de energia externa.
O propósito central de uma célula de eletrólise é converter energia elétrica em energia química. Utiliza uma tensão externa para impulsionar uma reação de oxirredução não espontânea, armazenando eficazmente a energia de entrada nas ligações químicas das moléculas resultantes de hidrogénio e oxigénio.

Os Componentes Centrais e os Seus Papéis
Uma célula eletrolítica para água opera através da interação precisa de três partes principais: os elétrodos, o eletrólito e a fonte de energia. Cada um desempenha um papel distinto e crítico no processo.
Os Elétrodos: Ânodo e Cátodo
A célula contém dois elétrodos, que são condutores através dos quais a eletricidade entra e sai da solução. Estes são tipicamente feitos de um material inerte, como platina ou grafite, para garantir que facilitam a reação sem serem consumidos por ela.
O ânodo é o elétrodo positivo. Este é o local da oxidação, onde as substâncias perdem eletrões.
O cátodo é o elétrodo negativo. Este é o local da redução, onde as substâncias ganham eletrões.
O Eletrólito: Tornando a Água Condutora
A água pura é um condutor de eletricidade muito fraco porque contém demasiado poucos iões livres para transportar uma corrente eficazmente.
Para resolver isto, é adicionada uma pequena quantidade de um eletrólito, como ácido sulfúrico (H₂SO₄). O eletrólito dissolve-se na água e fornece iões móveis (neste caso, H⁺ e SO₄²⁻) que podem transportar carga entre os elétrodos, completando o circuito elétrico.
A Fonte de Energia: Impulsionando a Reação
A decomposição da água é uma reação endergónica, o que significa que requer uma entrada de energia para ocorrer. A água é estável e não se decompõe espontaneamente.
Uma fonte de energia externa, como uma bateria ou uma fonte de corrente contínua (CC), fornece a tensão necessária. Esta pressão elétrica "empurra" eletrões para o cátodo e "puxa-os" do ânodo, forçando a decomposição química da água a prosseguir.
O Processo Químico: Como a Água é Decomposta
O processo geral é uma reação de oxirredução (redução-oxidação), dividida em duas meias-reações distintas que ocorrem em cada elétrodo.
Oxidação no Ânodo (+)
No ânodo positivo, as moléculas de água são oxidadas. Elas cedem os seus eletrões, que depois fluem para fora da célula para o circuito externo.
Esta reação produz gás oxigénio (O₂) e iões de hidrogénio (H⁺). A meia-reação é: 2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
Redução no Cátodo (-)
Os iões de hidrogénio (H⁺) gerados no ânodo (e presentes a partir do eletrólito ácido) são atraídos para o cátodo negativo.
No cátodo, estes iões ganham eletrões que estão a fluir do circuito externo. Esta reação de redução produz gás hidrogénio (H₂). A meia-reação é: 4H⁺(aq) + 4e⁻ → 2H₂(g)
A Reação Global
Quando se combinam as duas meias-reações, os eletrões e os iões de hidrogénio de ambos os lados anulam-se, revelando o resultado geral simples e elegante da eletrólise da água.
A alteração química líquida é: 2H₂O(l) → 2H₂(g) + O₂(g). Para cada duas moléculas de água decompostas, são produzidas duas moléculas de gás hidrogénio e uma molécula de gás oxigénio.
Compreender as Considerações Chave
Embora o conceito seja direto, vários fatores são críticos para que a célula funcione correta e eficientemente. Compreender estas limitações revela a verdadeira natureza do processo.
Porque é que a Água Pura Falha
Sem um eletrólito, a resistência da água é extremamente elevada. Aplicar uma tensão resultaria num fluxo de corrente negligenciável e, portanto, numa produção de hidrogénio ou oxigénio praticamente nula. O eletrólito não é consumido; a sua única função é atuar como um transportador de carga.
O Material do Elétrodo é Crucial
Utilizar elétrodos inertes como a platina é essencial. Se se utilizasse um metal reativo como o zinco ou o cobre para o ânodo, o próprio ânodo oxidar-se-ia e dissolver-se-ia na solução em vez da água. Isto produziria produtos diferentes e não intencionais e destruiria o elétrodo.
A Entrada de Energia Determina a Saída
A eletrólise não é uma fonte de energia gratuita; é um processo de conversão de energia. A quantidade de hidrogénio e oxigénio produzida é diretamente proporcional à quantidade de carga elétrica passada através da célula. É necessária uma quantidade significativa de energia elétrica para produzir uma pequena quantidade de gás hidrogénio.
Fazer a Escolha Certa para o Seu Objetivo
Compreender a célula de eletrólise é valioso para várias disciplinas. A sua conclusão depende do seu objetivo subjacente.
- Se o seu foco principal for a química fundamental: Veja isto como uma demonstração perfeita de como a energia elétrica pode forçar uma reação de oxirredução não espontânea, separando um composto estável nos seus elementos.
- Se o seu foco principal for a energia renovável: Reconheça a eletrólise como um método chave para o armazenamento de energia, convertendo o excesso de eletricidade de fontes como solar ou eólica em combustível de hidrogénio.
- Se o seu foco principal for a aplicação prática: Lembre-se de que a eficiência, a taxa e os produtos da eletrólise dependem inteiramente dos materiais específicos utilizados — o eletrólito, o material do elétrodo e a tensão aplicada.
Em última análise, a eletrólise da água é um processo poderoso que utiliza eletricidade para desbloquear a energia química armazenada numa molécula simples.
Tabela de Resumo:
| Componente | Papel na Célula de Eletrólise |
|---|---|
| Ânodo (Elétrodo Positivo) | Local de oxidação; produz gás oxigénio (O₂). |
| Cátodo (Elétrodo Negativo) | Local de redução; produz gás hidrogénio (H₂). |
| Eletrólito | Torna a água condutora; fornece iões para transportar a corrente. |
| Fonte de Energia | Fornece a energia elétrica para impulsionar a reação não espontânea. |
Pronto para integrar a tecnologia de eletrólise nos seus fluxos de trabalho laboratoriais? A KINTEK especializa-se em equipamentos laboratoriais e consumíveis de alta qualidade para processos químicos avançados. Quer esteja a desenvolver novas soluções de armazenamento de energia ou a realizar investigação fundamental, a nossa experiência garante que dispõe do equipamento fiável de que necessita. Contacte a nossa equipa hoje para discutir como podemos apoiar os seus requisitos laboratoriais específicos.
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica de Banho de Água de Cinco Portas de Camada Dupla
- Célula Eletrolítica Tipo H Tripla Eletroquímica
- Célula de Gás de Eletrólise Eletroquímica Eletrolítica Célula de Reação de Fluxo Líquido
As pessoas também perguntam
- Quais características ópticas a célula eletrolítica tipo H possui? Janelas de quartzo de precisão para fotoeletroquímica
- Como deve ser armazenada a célula eletrolítica tipo H quando não estiver em uso? Guia Especializado de Armazenamento e Manutenção
- Quais são as principais características de uma célula eletrolítica de banho-maria de dupla camada? Obtenha Controle Preciso de Temperatura para Seus Experimentos
- O que é uma célula tipo H? Um Guia para Células Eletroquímicas Divididas para Experimentos Precisos
- Qual é o sistema experimental típico usado com uma célula eletrolítica de banho de água de dupla camada? Alcance Controle Eletroquímico Preciso



















