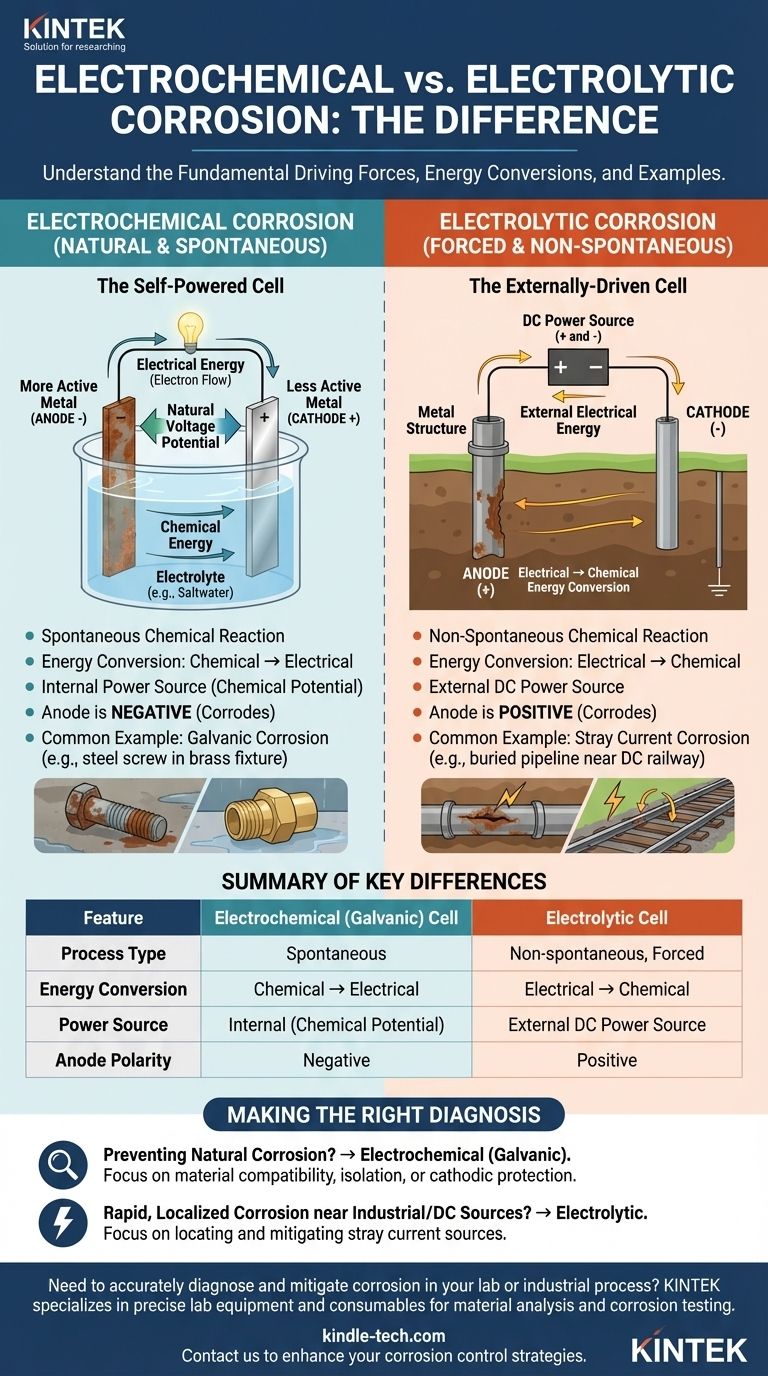
Em um nível fundamental, a diferença entre uma célula de corrosão eletrolítica e uma eletroquímica reside na sua conversão de energia e força motriz. Uma célula eletroquímica é um processo espontâneo que converte energia química armazenada em energia elétrica, causando corrosão natural. Em contraste, uma célula eletrolítica é um processo não espontâneo que usa energia elétrica externa para forçar uma reação química, causando corrosão induzida.
A distinção central é a espontaneidade. A corrosão eletroquímica acontece naturalmente por si só, como uma bateria descarregando. A corrosão eletrolítica é imposta a um material por uma fonte de energia externa, como corrente contínua (CC) parasita de um sistema ferroviário.

A Célula Eletroquímica: O Estado Natural da Corrosão
Uma célula eletroquímica, frequentemente chamada de célula galvânica, é o mecanismo por trás das formas mais comuns de corrosão. É um processo autônomo e de ocorrência natural.
Uma Reação Química Espontânea
Este tipo de célula se forma quando dois metais diferentes estão em contato elétrico na presença de um eletrólito (como água salgada). Existe um potencial de voltagem natural entre eles.
O metal mais quimicamente ativo torna-se o ânodo (eletrodo negativo) e corrói, liberando elétrons. O metal menos ativo torna-se o cátodo (eletrodo positivo) e aceita esses elétrons.
Conversão de Energia: Química para Elétrica
A força motriz é a liberação de energia química armazenada dentro do metal mais ativo. Essa energia química é convertida diretamente em energia elétrica na forma de fluxo de elétrons do ânodo para o cátodo. Este processo não requer energia externa.
Um exemplo clássico é a corrosão galvânica, onde um parafuso de aço (ânodo) enferruja rapidamente quando conectado a um acessório de latão (cátodo) em um ambiente úmido.
A Célula Eletrolítica: Corrosão por Força
Uma célula eletrolítica impulsiona uma reação química que normalmente não ocorreria. Ela faz isso aplicando uma fonte externa de energia elétrica.
Uma Reação Química Não Espontânea
Este processo supera as tendências naturais dos materiais envolvidos. A fonte de energia externa força um metal a se tornar um ânodo e corroer, mesmo que fosse estável de outra forma.
A corrosão ocorre onde esta corrente contínua (CC) fornecida externamente deixa a estrutura metálica para entrar em um eletrólito.
Conversão de Energia: Elétrica para Química
Aqui, a energia elétrica de uma fonte externa é convertida em energia química, que se manifesta como a reação de corrosão. A célula consome energia para operar.
Um cenário comum no mundo real é a corrosão por corrente parasita. Um oleoduto enterrado próximo a uma ferrovia alimentada por CC pode captar corrente de fuga, forçando a seção do tubo onde a corrente sai de volta para o solo a corroer a uma taxa acelerada.
Compreendendo as Principais Diferenças
Embora ambos os processos envolvam ânodos, cátodos e um eletrólito, suas características fundamentais são opostas. Reconhecer essas diferenças é fundamental para um diagnóstico e mitigação adequados.
Força Motriz e Fonte de Energia
A distinção mais importante é a força motriz. Uma célula eletroquímica é autoalimentada pelo potencial químico diferente entre os materiais. Uma célula eletrolítica é alimentada externamente por uma fonte de CC externa.
Polaridade dos Eletrodos
A polaridade do ânodo e do cátodo é invertida entre as duas células, um ponto frequente de confusão.
- Em uma célula eletroquímica (galvânica), o ânodo (onde ocorre a corrosão) é negativo, e o cátodo é positivo.
- Em uma célula eletrolítica, a fonte de energia externa torna o ânodo (onde ocorre a corrosão) positivo, e o cátodo é negativo.
Implicações Práticas
Identificar incorretamente o tipo de célula de corrosão leva a soluções erradas. Por exemplo, mudar pares de materiais pode resolver um problema de corrosão galvânica, mas não fará nada para interromper a corrosão por corrente parasita.
Fazendo o Diagnóstico Correto
Compreender o mecanismo subjacente é o primeiro passo para um controle eficaz da corrosão. Sua abordagem diagnóstica deve ser guiada pelo tipo de célula suspeita.
- Se seu foco principal é prevenir a corrosão natural: Você provavelmente está lidando com uma célula eletroquímica (galvânica). Sua solução envolve a seleção de materiais compatíveis, isolamento elétrico ou aplicação de proteção catódica.
- Se você está investigando corrosão rápida e localizada perto de equipamentos industriais ou trânsito de CC: Você está quase certamente lidando com uma célula eletrolítica. Sua prioridade deve ser localizar e mitigar a fonte da corrente parasita externa.
Em última análise, saber se a corrosão está acontecendo naturalmente ou sendo forçada por uma influência externa dita toda a sua estratégia de prevenção e controle.
Tabela Resumo:
| Característica | Célula Eletroquímica (Galvânica) | Célula Eletrolítica |
|---|---|---|
| Tipo de Processo | Espontâneo | Não espontâneo, Forçado |
| Conversão de Energia | Química → Elétrica | Elétrica → Química |
| Fonte de Energia | Interna (Potencial Químico) | Fonte de Energia CC Externa |
| Polaridade do Ânodo | Negativa | Positiva |
| Exemplo Comum | Corrosão Galvânica (ex: aço/latão) | Corrosão por Corrente Parasita (ex: de ferrovias) |
Precisa diagnosticar e mitigar com precisão a corrosão em seu laboratório ou processo industrial?
Compreender o tipo exato de célula de corrosão é o primeiro passo para uma solução eficaz. Os especialistas da KINTEK são especializados no fornecimento dos equipamentos de laboratório e consumíveis precisos necessários para análise de materiais e testes de corrosão. Quer você esteja investigando reações galvânicas ou efeitos de corrente parasita, temos as ferramentas para apoiar sua pesquisa e garantir a integridade do material.
Entre em contato conosco hoje através do nosso formulário de contato para discutir suas necessidades específicas de laboratório e descobrir como as soluções da KINTEK podem aprimorar suas estratégias de controle de corrosão.
Guia Visual
Produtos relacionados
- Célula Eletrolítica Eletroquímica para Avaliação de Revestimentos
- Célula Eletrolítica Eletroquímica de Corrosão Plana
- Célula Eletroquímica Eletrolítica com Cinco Portas
- Célula Eletrolítica Eletroquímica Óptica de Dupla Camada Tipo H com Banho de Água
- Célula Eletrolítica de PTFE Célula Eletroquímica Resistente à Corrosão Selada e Não Selada
As pessoas também perguntam
- Como uma célula eletrolítica de alta precisão é usada para avaliar a resistência à corrosão de metais? Valide os resultados do DCT com precisão
- Para que tipo de sistema de eletrodos é projetada a célula eletrolítica de avaliação de revestimento? Desbloqueie a Análise Precisa de Revestimentos
- Qual é a faixa de volume da célula eletrolítica para avaliação de revestimento? Um guia para escolher o tamanho certo
- Qual é o papel de uma célula eletrolítica encamisada a água nas medições de corrosão eletroquímica com temperatura variável?
- Como uma célula eletrolítica eletroquímica de três eletrodos é utilizada para avaliar a resistência à corrosão da liga Zr-Nb?



















